デーベライナーのランプとは|仕組み・歴史・触媒作用をわかりやすく解説
デーベライナーのランプの仕組み・歴史・触媒作用をやさしく解説 水素と白金の触媒で点火する初期ライターの構造や1823年の開発背景、図解や博物館展示写真まで網羅
デーベライナーのランプは、初期の実用的なライターの一つです。1823年にドイツの化学者ヨハン・ヴォルフガング・デーベライナーによって発明され、19世紀中ごろから1880年頃まで製造・使用されました。現在ではハイデルベルク城やドイツ博物館には、当時のオリジナルが展示されており、化学史の重要な実験器具として知られています。
概要 — 何ができる器具か
デーベライナーのランプは、簡単な構造で水素を発生させ、その水素を用いて着火を行う装置です。一般家庭用のライターというよりは、当時は「点火具」として注目され、化学実験や実演に用いられました。構造は比較的単純で、硫酸と亜鉛を反応させて水素を発生させるボトルと、発生した水素を通すための通路、そして通路の先に触媒として置かれた白金片(または白金被覆)が組み合わさっています。
仕組み — 反応の流れをやさしく解説
操作の基本は次の通りです。まずガラスのシリンダー(右の写真のa)には硫酸が入っており、外側の開いた瓶(b)の中には亜鉛が入っています。上部にはバルブがあり、レバー(f)を操作して瓶を開閉します。レバーで瓶を開くと、硫酸が亜鉛に触れて化学反応が始まり、水素が発生します。
発生する反応は次のとおりです。
}
発生した水素ガスはボトルの上方へ上がり、バルブ近くに配置された白金片を通過します。ここで白金の触媒作用により、水素と空気中の酸素が反応して熱を出し、ガスの混合物(オキシ水素)が燃焼して水が生成されます。
化学反応(燃焼)は次のように表されます:
2 H 2 + O 2 ⟶ 2 H 2 O {displaystyle \mathrm {2 H_{2}+O_{2}\longrightarrow 2 H_{2}O}.}
触媒作用 — 白金(プラチナ)の役割
白金は化学的に安定でありながら、表面上で分子の吸着や解離を促す性質があります。デーベライナーのランプでは、白金表面に水素分子が吸着・解離して原子状水素になり、空気中の酸素と反応して再結合しやすくなるため、発火に必要な活性化エネルギーが大幅に下がります。つまり、白金は自らは消費されずに反応速度を高め、安定した発火を可能にする「触媒」として働きます。
さらに、触媒反応によって局所的に熱が発生し、その熱が周囲のガス混合物を発火点まで持ち上げることで、火炎が発生します。これがデーベライナーのランプが火を出す仕組みです。
使い方と停止方法
- レバーを下げて瓶内の硫酸が亜鉛に接触すると水素が発生し、白金を介して燃焼が始まります。
- 反応を止めるには、レバーを離して瓶を閉じ、硫酸が亜鉛に触れない状態に戻します。水素の発生が止まれば、ガス供給が途絶えて燃焼も消えます。ボトルを閉じることで硫酸がガラス筒内へ押し戻されるため、水素が外へ出られなくなります。
- 停止操作は確実に行わないと水素の蓄積や予期せぬ燃焼・爆発の危険があるため注意が必要です。
歴史的意義と普及・終焉
デーベライナーのランプは、当時としては安全で扱いやすい点火具として注目され、家庭用というよりは教育・実験用、また上流階級の嗜好品として使われました。しかし、製造コスト(白金の使用)や取り扱いの安全面、さらにより小型で扱いやすいマッチ(マッチ棒)や後の摩擦式ライター、フェロセリウムなどの新しい点火技術の登場により、1880年頃には次第に生産が終息しました。
安全性・取り扱い上の注意
- 硫酸と亜鉛の化学反応を利用するため、硫酸の希釈や取り扱いには腐食や火傷の危険があります。取り扱いは慎重に行う必要があります。
- 水素は可燃性かつ爆発性の高いガスなので、密閉空間での使用やガスが溜まる状況は危険です。
- 白金自体は触媒として再利用可能ですが、表面が汚れると触媒作用が低下するため、清掃やメンテナンスが必要です。
現在の価値と教育利用
今日では実用的な点火具ではありませんが、デーベライナーのランプは触媒作用やガス発生の原理を示す教材として、また化学史の重要な遺物として価値があります。博物館で実物を見学したり、教育用に再現実験が行われることもあります。歴史的な発明として、触媒化学の理解を深める良い題材です。
まとめると、デーベライナーのランプは、単純な化学反応と白金触媒の原理を利用して着火を行う装置であり、化学史上および触媒化学の教育上で重要な位置を占めています。
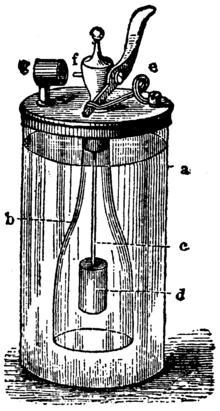
Döbereiner's lamp: a. ガラスシリンダー b. オープンボトル c. ワイヤ ード zince. ストップコック f. nozzleg. プラチナスポンジ

ドーベライナーのランプ
質問と回答
Q:デーベライナーのランプとは何ですか?
A: デベライナーのランプは、1823年にドイツの化学者ヨハン・ウォルフガング・デベライナーによって開発された最初のライターの1つです。1880年頃まで生産され、現在でもハイデルベルク城やドイツ博物館で見ることができます。
Q:どのように機能するのですか?
A:ライターの仕組みは、水素と酸素の化学反応に基づいています。ガラスの筒の中には硫酸が、上部のバルブ付きの空き瓶の中には亜鉛が貯蔵されています。レバーを開くと硫酸がボトルに流れ込み、水素ガスが発生し、白金を経由して空気中の酸素と反応し、発熱反応として水が発生します。この反応を止めるには、レバーを放して水素がボトルから出なくなるようにし、硫酸を元の容器に押し戻す必要がある。
Q:デーベライナーのランプを発明したのは誰?
A: デベライナーのランプは、1823年にドイツの化学者ヨハン・ウォルフガング・デベライナーによって発明されました。
Q: このライターのオリジナルはどこで手に入りますか?
A: このライターのオリジナルは、ハイデルベルク城とドイツ博物館で見ることができます。
Q: この化学反応にはどんな元素が使われるのですか?
A: この化学反応には、水素、酸素、亜鉛、硫酸、白金、水が使用されています。
Q:レバーを離すとどうなるのですか?
A:レバーを離すと、水素がボトルから出られなくなり、硫酸が元の容器に押し戻されて、それ以上の反応が起きなくなります。
百科事典を検索する

