化学電池の定義と仕組み|一次電池・二次電池の違いと用途
化学電池の基礎から一次電池・二次電池の仕組みと違い、用途や選び方までわかりやすく解説。
化学電池は、化学エネルギーを電気エネルギーに変換する装置です。ほとんどの電池は化学電池であり、内部での化学反応によって電子が放出され、外回路に電流が流れます。反応が進むと化学物質の状態が変わり、それに伴って電気を供給します。
一次電池と二次電池の違い
電池は大きく分けて、充電できない一次電池(使い切り)と、繰り返し充電できる二次電池(充電式)の2種類があります。
- 一次電池(使い捨て):内部の化学物質が不可逆に消費されるため、エネルギーが尽きると再利用できません。身近な例としては亜鉛炭電池やアルカリ電池、ボタン型の酸化銀電池、一次リチウム電池などがあります。
- 二次電池(充電式):外部から逆方向に電流を流すことで化学反応を元に戻し、再び電気を取り出せます。代表的なものに鉛蓄電池、Ni–Cd(ニッケルカドミウム)、Ni–MH(ニッケル水素)、リチウムイオン電池などがあります。二次電池を実用化したのは1859年にガストン・プランテ(Gaston Planté)が発明した鉛蓄電池です。
電池の仕組み(簡単な化学・物理の説明)
電池は二つの電極(負極=アノード、正極=カソード)と電解質で構成され、電極間で酸化還元反応が起きます。アノードで酸化(電子を失う)、カソードで還元(電子を受け取る)が生じ、失われた電子は外回路を通って移動します。一方、電解質中ではイオンが移動して電荷のバランスを保ちます。これが連続することで電流が供給されます。
電池の公称電圧(セル電圧)は使用する化学系により決まり、例えばアルカリ乾電池は約1.5V、Ni–MHやNi–Cdは約1.2V、リチウムイオンは約3.6〜3.7V、鉛蓄電池は1セルあたり約2.0Vです。出力特性には内部抵抗や温度、残容量が影響します。
主な電池の種類と用途
- アルカリ電池・亜鉛炭電池(一次):リモコンや懐中電灯、玩具などの低〜中消費電力機器に広く使われます。
- ボタン電池(酸化銀、酸化銀-マンガン、リチウム系):腕時計、電子機器のバックアップ、補聴器など小型機器向け。
- 鉛蓄電池(二次):自動車の始動用(バッテリー)、UPSや非常用電源、電動フォークリフトなど。大型で安価だが比エネルギーは低め。
- ニッケル系(Ni–Cd、Ni–MH):かつて携帯機器や電動工具に使われました。Ni–Cdはメモリー効果や環境問題があり、徐々に置き換えられています。
- リチウムイオン電池(Li-ion、二次):スマートフォン、ノートパソコン、電気自動車(EV)、蓄電システムなど、エネルギー密度と出力が高いため幅広く採用されています。
- 一次リチウム電池:高エネルギー密度で長寿命なため、医療機器や長期間使う機器に向いています。
性能指標と注意点
- 容量(Ah、mAh)とエネルギー(Wh):電池がどれだけの電流を供給できるかを示す指標。消費機器の電流と電池容量から使用時間を概算できます。
- サイクル寿命:二次電池は充放電回数で寿命が表されます。鉛蓄電池は数百回、Li-ionは数百〜数千回が目安です(使用条件で大きく変動)。
- 自己放電:保管中に自然に失われる電荷。Ni系は自己放電が比較的大きく、リチウム系は低めです。
- 安全性:短絡や過充電、過放電、高温で発火や液漏れ・爆発の危険があります。特にリチウムイオンは熱暴走のリスクがあるため、充電器や保護回路、適切な取り扱いが重要です。
- 環境・廃棄:電池には重金属や有害物質が含まれることがあるため、自治体のルールやリサイクル窓口に従って適切に廃棄・リサイクルしてください。
実用上のアドバイス
- 機器に合った電池の種類と規格(サイズ、電圧)を選ぶ。混ぜて使う(異種・新旧混合)は避ける。
- 長期保存する場合は温度の低い乾燥した場所に保管し、特に二次電池は完全放電状態での長期放置を避ける。
- 充電式電池は専用の充電器を使い、過充電や高温を避ける。異臭や膨張が見られたら直ちに使用を中止する。
電池は、おもちゃやカメラに使われている非常に小さなものから、自動車に使われているもの、さらには大きなものまで、さまざまな形と用途があります。大型の潜水艦や電気推進船、電力貯蔵用途では、非常に大きな電池が必要になります(例:潜水艦や陸上蓄電システム)。
化学電池の種類
電気化学セル
非常に重要な酸化反応と還元反応は、電池で有用な電気エネルギーを供給するために使用されます。単純な電気化学セルは、銅と亜鉛の金属とそれらの硫酸塩の溶液から作ることができる。反応の過程で、電子は有用な電流として導電性の経路を通って亜鉛から銅に移動することができる。
電気化学セルは、金属電極を電解液中に置き、化学反応によって電流を使用または発生させることで作られる。電流を発生させる電気化学電池はボルタ電池やガルバニック電池と呼ばれ、一般的な電池はこのような電池を1つ以上組み合わせたものである。また、外部から電流を供給して、自然には起こらない化学反応を起こさせる電気化学電池もある。このようなセルは電解槽と呼ばれる。
ボルタチック・セル
金属は電子を失う性質が異なるため、2種類の金属を使って外部に電流を流す電気化学セルを作ることができる。亜鉛は銅よりも電子を失いやすいので、亜鉛と銅の金属をそれぞれの塩の水溶液に入れると、亜鉛から銅につながる外部の電線に電子が流れるようになる。亜鉛原子が電子を提供すると、亜鉛原子は正イオンとなって水溶液中に入り、亜鉛電極の質量が減少します。銅側では、受け取った2つの電子によって、水溶液中の銅イオンが電荷を持たない銅原子に変化し、銅電極に付着して質量が増加します。この2つの反応は通常、次のように書かれます。
Zn(s)→Zn2+(aq)+2e -
Cu2+(aq) + 2e ---> Cu(s)
括弧内の文字は、亜鉛が固体(s)から水溶液(aq)になり、銅がその逆になることを示しています。電気化学の用語では、この2つの過程を、2つの電極で起こる「半反応」と呼ぶのが一般的です。
| Zn(s)→Zn2+(aq)+2e - |
|
| Cu2+(aq) + 2e --> Cu(s) |
ボルタ電池が外部から電流を流し続けるためには、溶液中の硫酸イオンを右から左に移動させて、外部回路の電子の流れとバランスさせる必要がある。金属イオンが電極間を移動することはできないので、多孔質膜などを用いて、電解液中のマイナスイオンを右から左へ選択的に移動させる必要がある。
電子を亜鉛電極から銅電極に移動させるためにはエネルギーが必要であり、ボルタ電池から得られる単位電荷あたりのエネルギー量を電池の起電力(emf)という。単位電荷あたりのエネルギーはボルトで表される(1ボルト=1ジュール/クーロン)。
明らかに、セルからエネルギーを得るためには、銅を還元するのに必要なエネルギーよりも、亜鉛の酸化から放出されるエネルギーを多く得なければなりません。セルがこのプロセスから得られるエネルギー量には限りがあり、プロセスは電解液または金属電極の中で利用可能な物質の量によって制限されます。例えば、銅側に硫酸イオンSO42-が1モルあったとすると、外部回路を介して2モルの電子を移動させるのが限界であるということになる。1モルの電子に含まれる電荷量をファラデー定数といい、アボガドロ数に電子の電荷をかけたものである。
ファラデー定数=F=ANe=6.022×1023×1.602×10-19=96,485 クーロンブス/モル
ボルタ電池のエネルギー収量は、電池電圧×移動する電子のモル数×ファラデー定数で与えられる。
電気エネルギー出力=nFE cell
セル起電力Ecellは、2つの金属の標準電極電位から予測することができます。標準的な条件での亜鉛/銅電池の場合、計算されたセル電位は1.1ボルトです。
シンプルセル
単純細胞は、希硫酸の中に銅(Cu)と亜鉛(Zn)の板を置いたものです。亜鉛が溶けると、銅板上に水素の泡が発生します。この水素の泡が電流の通過を妨げるため、単セルは短時間しか使用できない。安定した電流を流すためには、水素を酸化させるための脱分極剤(酸化剤)が必要である。ダニエル電池の場合、脱分極剤は硫酸銅で、水素と銅を交換する。ルクランシェ電池では、二酸化マンガンが水素を酸化して水に変える。
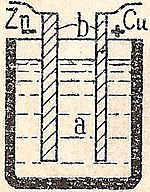
シンプルセル
ダニエル・セル
イギリスの化学者、ジョン・フレデリック・ダニエルが1836年に開発したボルタ電池は、亜鉛と銅、それらのイオンを溶かした溶液を使用していた。
キー
- ジンクロッド=マイナス端子
- HSO24=希硫酸の電解質
- 多孔質のポットが2つの液体を分離
- CuSO4 = 硫酸銅の偏光解消剤
- 銅製ポット=プラス端子
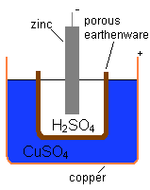
ダニエル・セルの図
質問と回答
Q:化学電池とは何ですか、またその目的は何ですか?
A: 化学電池とは、化学エネルギーを電気エネルギーに変換する装置です。化学反応により電流を発生させることを目的としています。
Q: ほとんどの電池は何ですか?
A: ほとんどの電池は化学電池です。
Q: 電池の中では何が起こって電流が流れるのですか?
A:電池の内部で化学反応が起こり、電流が流れます。
Q: 電池には何種類あって、どんなものがあるのですか?
A:大きく分けて、充電式と非充電式の2種類があります。
Q:充電式でない電池を使い切るとどうなるのですか?
A:非充電式電池は、中の化学物質を使い切るまで電気を供給することができます。そうすると、もう使えなくなるので、捨てることができます。
Q:二次電池はいつ、誰が発明したのですか?
A:充電式電池は、1859年にフランスの科学者ガストン・プランテによって発明されました。
Q: 電池にはいろいろな大きさがありますが、大きな電池を必要とする機器の例は何ですか?
A: はい、電池には様々な形や大きさがあります。大きな電池を必要とする装置の例としては、潜水艦があります。
百科事典を検索する