電池とは:仕組み・一次・二次の違い・主な用途をわかりやすく解説
電池の仕組みから一次電池・二次電池の違い、携帯や電気自動車などの主な用途までを図解と事例で初心者にもわかりやすく解説。選び方や環境影響も掲載。
電池は、化学反応によって化学エネルギーを電気エネルギーに変換する装置です。通常、化学物質は電池の内部に封入され、回路に接続して他の部品へ電力を供給します。電池は一方向に流れる直流(DC)電気を生み出し、モバイル機器やリモート機器、産業用機器などで広く使われています。
家庭や建物の中のコンセントからの電気を使うのが一般に安くて効率的ですが、配電設備のない場所や持ち運びが必要な場合、電池があれば電気を供給できます。また、電気自動車や携帯電話など、移動する機器に電力を供給する点でも電池は不可欠です。
電池には一次電池と二次電池があります。一次電池は化学反応が一方向に進むため、放電が終わると使い切りで廃棄します。二次電池は充電して化学反応を逆方向に戻すことで繰り返し使えます。以下で仕組みや違い、代表的な種類と用途についてわかりやすく解説します。
電池の仕組み(基本)
電池は主に正極(カソード)、負極(アノード)、そしてそれらをつなぐ電解質から構成されます。放電時には、負極で酸化反応が起こり電子が放出され、外部回路を通って正極へ移動します。同時にイオンは電解質を通って内部でバランスを取ります。外部回路を流れる電子が電流となり、機器に電力を供給します。
重要なポイント:
- 起電力(電圧)は電極材料の組み合わせで決まります。
- 容量(電気量)は電極や電解質の量、内部構造で決まります(mAhやAhで表されます)。
- 内部抵抗が小さいほど高い電流を取り出せますが、発熱や電圧低下が発生することもあります。
- 直列接続で電圧を高く、並列接続で容量(持続時間)を増やせます。
一次電池と二次電池の違い
一次電池の特徴:
- 使用が終わったら交換・廃棄する使い捨て型(例:アルカリ乾電池、酸化銀ボタン電池、リチウム一次電池)。
- 自己放電が比較的少なく、長期保存に向くものが多い。
- 充電不可なので、充電器にかけると危険な場合がある(発熱や破裂の恐れ)。
二次電池の特徴:
- 充電を繰り返して使える(例:鉛蓄電池、ニッケル水素(NiMH)、リチウムイオン(Li-ion))。
- サイクル寿命(充放電回数)や充電特性、内部抵抗などが機器用途に応じて重要。
- 充電方法(定電流、定電圧など)を正しく行わないと劣化や危険につながる。
主な種類とその特徴
- アルカリ乾電池:一次電池。低コストで一般家庭用機器に広く使用。
- リチウム一次電池(コイン電池含む):エネルギー密度が高く、長期保存向き。時計や電子機器、バックアップ用に利用。
- 鉛蓄電池:二次電池。自動車用バッテリーや無停電電源装置(UPS)で利用。コストは低めで高い瞬間出力が得られる。
- ニッケル水素(NiMH):二次電池。単三・単四形で家庭用から業務用まで広く使われる。メモリー効果はニッケルカドミウムほど深刻ではない。
- リチウムイオン(Li-ion):二次電池。高エネルギー密度でノートPCやスマートフォン、電気自動車に主に採用。充放電効率が高く、軽量。
- リチウムポリマー(LiPo):Li-ion系の一種で薄型・軽量化が可能。ドローンやモバイル機器に使われる。
主な用途
- ポータブル電子機器(スマートフォン、ノートPC、携帯音楽プレーヤーなど):高いエネルギー密度と軽量さが重要。
- 電気自動車(EV)やハイブリッド車:大容量で高出力、長寿命の二次電池(主にリチウムイオン系)が使われる。
- 家庭用・産業用の非常用電源(UPS、非常用照明、監視カメラ):信頼性と迅速な出力が求められる。
- 定置型蓄電(再生可能エネルギーの蓄電、ピークシフト):大型の二次電池やフロー電池などが利用される。
- 医療機器(ペースメーカー、携帯医療機器):高信頼性・長寿命・安全性が最重要。
- 小型センサーやリモコン、玩具、時計など:用途に応じて一次電池や小型二次電池が使われる。
取り扱いと環境面の注意点
電池は機能上および安全上の注意が必要です。主な注意点:
- 電池を短絡(+と−を直接つなぐ)させると大電流が流れて発熱・発火の原因になります。
- 一次電池を充電しない(危険)。二次電池はメーカー指定の充電器・条件で充電する。
- 高温や過放電、過充電は劣化や安全問題(発火、破裂)を招くため避ける。
- 使用済み電池は各自治体や回収ルートに従って適切に回収・リサイクルする。特にリチウムイオンや鉛蓄電池はリサイクルが推奨される。
- 製造・廃棄時の環境負荷(有害物質、資源採掘)にも配慮が必要で、リサイクルや長寿命設計が重要。
まとめると、電池は化学エネルギーを電気エネルギーに変換する便利なエネルギー源であり、用途に応じて一次・二次の特性を使い分けることが重要です。安全に正しく使い、廃棄やリサイクルにも注意しましょう。

電池の模式図
電池の中の化学物質
電池には1つのセルと複数のセルがあります。各セルには、負極、正極、電解質があります。電解液は、バッテリー内部の主な物質です。多くの場合、酸の一種であり、触れると危険です。陽極は、電解液と反応して電子を生成します(これはマイナスまたは-端です)。陰極は電解液と反応して電子を奪います(これはプラスまたは+の端です)。電線が陽極と陰極をつなぎ、電子が一方から他方へ移動することで電流が発生する。(しかし、電線で両端をつないだだけでは電池は壊れてしまうので、両端の間には負荷が必要になります。負荷とは、電子の動きを遅くするもので、懐中電灯の電球や電卓の電子回路のように、通常は何か役に立つことをしています)。電解質には液体と固体がある。電池は、電解質の種類によって、湿式電池、乾式電池と呼ばれています。
電池の中で起こる化学反応は発熱反応です。この種の反応は熱を作ります。例えば、ノートパソコンの電源を長時間入れたままにしておいて、バッテリーに触れると温かくなったり、熱くなったりしますよね。
二次電池は、電池内で起こる化学反応を逆転させることで充電します。しかし、二次電池は決められた回数(充電寿命)しか充電できません。内蔵された電池であっても、永遠に充電することはできないのである。また、充電するたびに、電池の保持力は少しずつ低下していきます。充電できない電池は、水酸化カリウムなどの様々な有害物質が漏れ出す可能性があるので、充電してはいけません。
セルを接続することで、より大きなバッテリーを作ることができます。ある電池のプラスと次の電池のマイナスをつなぐことを「直列接続」という。それぞれの電池の電圧を合計します。6Vの電池を2個直列につなぐと12Vになります。
一方のセルのプラスをもう一方のセルのプラスに、マイナスをマイナスに接続することを「並列接続」といいます。電圧はそのままで、電流が加算されます。電圧とは、電子を電線の中に押し出す圧力のことで、単位はボルトです。電流とは、電子が一度にどれだけ進むことができるかを示すもので、単位はアンペアです。電流と電圧の組み合わせが、バッテリーのパワー(ワット=ボルト×アンペア)となります。
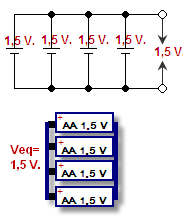
並列に接続されたバッテリー - 回路図と図面で示される
バッテリーサイズ
電池には様々な形や大きさ、電圧があります。アルカリ乾電池を含むAA、AAA、C、Dセルは、標準的なサイズと形状で、約1.5ボルトの電圧を持っています。セルの電圧は、使用する化学物質によって決まる。電池の電圧は使用する化学物質によって異なり、供給できる電気量は電池の大きさや使用する化学物質によって異なる。電池の充電量は通常、アンペア時間で表される。電圧は変わらないので、充電量が多ければ大きいほど、より多くのアンペアを供給でき、より長い時間作動させることができます。
沿革
初めて電池が発明されたのは 1800アレッサンドロ・ボルタが発明した。今ではボルタ電池と呼ばれていますが、この電池は「ボルタの山」と呼ばれています。最近の小型電池は、液をペースト状にして固定化し、すべてを密閉したケースに入れている。このケースのおかげで、電池の外には何もこぼれない。自動車用バッテリーなどの大型バッテリーは、内部に液体が残っており、密閉されていない。電解質に溶融塩を使用するタイプの電池は、第二次世界大戦中に発明された。
電池の種類
- 乾電池:電解質として液体を含まない(またはペーストやゲルなどの固定化された液体を含む)電池

カーバッテリーの上面図
電池に代わるもの
燃料電池や太陽電池は、エネルギーを内部に蓄積しないため、電池ではありません。コンデンサは、化学反応のエネルギーを蓄えるものではないので、電池とは異なります。コンデンサは、電気を蓄えたり、電池よりもはるかに速く電気を作り出したりすることができるが、通常、電池のように大きくするにはコストがかかりすぎる。科学者や化学技術者たちは、電気自動車のために、より優れたコンデンサーやバッテリーを作るために努力している。
手や足で操作する小型の発電機は、小型の電気機器に電力を供給することができる。時計式ラジオや時計式トーチなども、機械的エネルギーを蓄えるためにゼンマイを巻いています。
質問と回答
Q:バッテリーとは何ですか?
A:電池とは、化学反応によって化学エネルギーを電気エネルギーに変換する装置です。
Q: 電池はどのようにして電気を作るのですか?
A:電池は直流(DC)電気を発生させます。この電気は一方向に流れ、前後に切り替わることはありません。
Q: 電池の中の化学物質はどこにあるのですか?
A:通常、化学物質は電池の中に保管されています。
Q: 一次電池と二次電池はどう違うのですか?
A:一次電池は電気を供給できなくなると捨てられますが、二次電池は充電して再利用することができます。
Q:電池はなぜ便利なのですか?
A:電気自動車や携帯電話など、移動するものや配電のない場所で電気を供給するのに便利です。
Q: 建物のコンセントの電気を使う方が、電池を使うより安くて効率的なのでしょうか?
A:はい、建物内のコンセントの電気を使う方が、電池を使うよりも安く、効率的です。
Q: 電池はどんな電気を作るのですか?
A:直流(DC)電気です。
百科事典を検索する