電気環状反応の同回転と逆回転概説:軌道対称性とウッドワード–ホフマン則
電気環状反応の同回転・逆回転を軌道対称性とウッドワード–ホフマン則でわかりやすく解説。4n+2/4n電子系の熱・光誘起再配列や立体化学を図解で完全理解。
電気環状反応は、閉環と開環が電子の協調した回転(軌道の位相変化)によって進行する有機化学反応の一種です。反応における端位のπ軌道の回転様式は大きく二つに分かれます。すなわち、末端置換基が環化(または開環)に際して同じ方向に回転する「同回転(conrotatory)」と、末端が反対方向に回転する「逆回転(disrotatory)」です。元の語句では「逆回転モードでは、それらは反対方向に移動する」と表現されていましたが、意味は上のとおりです。
基本的な原理:軌道対称性とHOMO
電気環状反応の立体化学(どの向きに回るか)は、反応基質の最高占有分子軌道(HOMO)や励起状態の軌道対称性によって決まります。環化で新しいσ結合を形成するためには、末端のπ軌道の位相(符号)が一致して結合形成が可能でなければなりません。HOMOの位相分布に基づき、末端軌道が同方向に回る(同回転)か、反対方向に回る(逆回転)かが決まります。
電子数と温度/光の違い(4n と 4n + 2)
ウッドワード–ホフマン則に従うと、電子の総数(閉じた共役環系でのπ電子数)が反応の回転様式を決定します。要点をまとめると:
- 熱的反応(熱で進行する場合)
- 4n + 2 π電子(例:6π、10π …)系 → 逆回転(disrotatory)が立体選択的に進む。
- 4n π電子(例:4π、8π …)系 → 同回転(conrotatory)が進む。
- 光化学反応(光励起された場合)
- 上記の規則は逆転する:4n + 2 系では同回転、4n 系では逆回転が優勢になる。
この転換は、励起によって電子がHOMOからLUMOへ移動し、実効的な占有軌道の対称性が変化するためです。結果として、位相整合のために求められる回転様式も逆になります。
具体例と図示
例として、元の文で挙げられている「トランス‑シス‑トランス‑2,4,6‑オクタトリエンからシス‑ジメチルシクロヘキサジエンへの変換」は、6π(4n + 2, n=1)系の熱的な環化であり、軌道対称性の観点から逆回転(disrotatory)が要求されます。すなわち、オクタトリエンのHOMOにおける位相配置を新しいσ結合に適合させるため、末端のπ軌道は反対方向に回転して位相が一致するようになります。

上の図は、conrotatory(同回転)とdisrotatory(逆回転)の違いを示しています。図を観察すると、末端置換基の相対立体配置(反対側へ向くか同じ側へ向くか)が回転様式によって変わることが分かります。これが立体化学的帰結(生成物のcis/transやエナンチオ選択性)につながります。
ウッドワード–ホフマン則と保存則
ウッドワード-ホフマンのルールは、これらの観察を一般化したもので、反応における軌道対称性の保存(保存則)に基づいて、どのような軌道相互作用が許されるかを示します。簡潔に言えば、反応経路に沿って軌道の対称性が連続的に相関できる場合、その経路は「許容される(allowed)」反応として起こりやすく、相関できない場合は「禁制(forbidden)」となります。電気環状反応においては、これが同回転/逆回転の選択を支配します。
実務上の注意点
- 置換基の立体配座や立体障害、溶媒や温度、触媒の存在は理想的な軌道対称性の議論を変えることがあり、例外的な経路を取る場合もあります。
- 光励起条件や多重項状態の関与、张力の解放などが関わると、単純な4n/4n+2の規則だけでは説明できない反応もあります。そうした場合は軌道相互作用の詳細な解析(計算化学や実験的立体化学解析)が必要です。
まとめると、電気環状反応の同回転と逆回転の違いは、HOMO(あるいは励起状態の占有軌道)の位相分布とπ電子数に基づく軌道対称性の保存により説明されます。これらを体系化したものがウッドワード-ホフマンのルールであり、温度か光か、電子数が4nか4n+2かによってどちらの回転様式が起こるかが決まります。
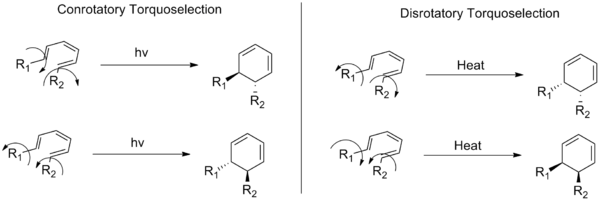
一般的なヘキサトリエン系のエナンチオマーのペアをもたらす回転の2つの可能な方向を示す回転の回転のConrotatoryとdisrotatoryの各モード。
質問と回答
Q:電気化学反応とは何ですか?
A:電気環式反応とは、共役二重結合が開閉して環を形成する有機化学反応の一種です。
Q: コンロータトリーモードとディスロータトリーモードの違いは何ですか?
A: 共役二重結合の末端にある置換基が、開環または閉環する際に同じ方向(時計回りまたは反時計回り)に動くのが共回転型です。一方、逆回転モードでは、反対方向に移動する。
Q: 軌道の対称性は、これらの反応にどのように影響するのでしょうか?
A: 反応がconrotatoryな法則に従うかdisrotatoryな法則に従うかを決定する際に、反応の軌道力学を考慮する必要がある。例えば、4n + 2 pi電子を含む系は立体特異的で、最高被占分子軌道(HOMO)の軌道対称性が保たれているため、conrotatory ruleに従います。4n 個のπ電子を含む系では、逆のdisrotatory modeを示す。これは、4n + 2 pi (nは整数) の電子が光によって転位する場合にも当てはまる (光誘起)。4n pi電子系(電子数が4で割り切れる)の光誘起転位は、逆回転則に従う。
Q: ウッドワード-ホフマン則とは何ですか?
A: Woodward-Hoffmann則は、様々なタイプの電気化学反応と、それらが軌道の対称性や光エネルギーの有無などの要素にどのように影響されるかをまとめたものである。
Q:この絵は何を示しているのですか?
A: trans-cis-trans-2,4,6-octatrieneからcis-dimethylcyclohexadieneへの変換の例で、上から見てconorotaryモードかdisrorotaryモードか(それぞれ時計回りか反時計回り)によって置換基の動き方が異なることを説明している図である。
百科事典を検索する