電子殻とは?定義と構造—主量子数・サブシェル・2n²の法則(ボーア模型由来)
電子殻の定義と構造を図解で分かりやすく解説。主量子数・サブシェルの違い、2n²の法則やボーア模型の由来まで学べる入門ガイド。
電子殻とは、原子核の周りに分布する電子が主に占有する領域で、同じ主量子数nを持つ原子軌道の集合です。観測上は「殻」と名付けられる離散的なエネルギー準位があり、それぞれに複数の軌道(原子軌道)が含まれます。
構造:サブシェル(サブレベル)と軌道
各電子殻は、いくつかの電子サブシェル(サブレベル)に分かれます。これらのサブシェルは、同じ角運動量量子数lをもつ複数の原子軌道(磁気量子数mによる違いで区別)を含みます。代表的なサブシェルは次のとおりです:
- s(l=0):1種類の軌道、1つの軌道あたり最大2個の電子
- p(l=1):3種類の軌道(m=-1,0,1)、合計で最大6個の電子
- d(l=2):5種類の軌道、合計で最大10個の電子
- f(l=3):7種類の軌道、合計で最大14個の電子
各軌道は最大で2個の電子を収容できます(パウリの排他原理による。同じ軌道内の2電子はスピンが逆向き)。
殻ごとの電子数:2n²の法則と導出
ある主量子数nの殻に入ることができる電子の総数は次の式で表されます:
2 n 2 {\displaystyle 2n^{2}} 
これは各サブシェルに含まれる電子数を合計して導出できます。主量子数nの殻にはl=0,1,...,n−1 のサブシェルが存在し、それぞれのサブシェルに含まれる軌道数は (2l+1)、各軌道は最大2電子を取るため総和は
2 × Σ_{l=0}^{n-1} (2l + 1) = 2 × n² = 2n²
具体例:
- n=1(K殻): 2 × 1² = 2 個(1sのみ)
- n=2(L殻): 2 × 2² = 8 個(2s + 2p)
- n=3(M殻): 2 × 3² = 18 個(3s + 3p + 3d)
ボーア模型との関係と現代的理解
「殻」という名称は、電子が一定の軌道半径で原子核の周りを回ると想定した古典的なボーアモデルに由来します。ボーアは電子が離散的な軌道上に存在すると考え、その軌道群が“殻”を形成すると説明しました。現代の量子力学では、電子は厳密な点状の軌道を回るわけではなく、確率分布として記述されますが、エネルギー準位の離散性や殻・サブシェルという概念は依然として有用です。
電子配置と化学的意義
電子殻とサブシェルの配置は元素の化学的性質(価電子数、結合性、周期表での位置)を決定します。電子の配置は基本的にオーフバウの原理(低エネルギー準位から順に電子を入れる)に従いますが、CrやCuのように例外的な配置をとる元素もあります。
まとめると、電子殻は同じ主量子数nを共有する原子軌道の集合であり、サブシェルや軌道、パウリの排他原理と組み合わさることで各殻の最大電子数(2n²)が決まります。用語や概念自体はボーア模型に由来しますが、現在では量子力学的な確率分布として理解されています。
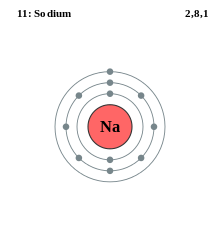
3つの殻を持つナトリウム電子殻モデルの例
バレンスシェル
原子価殻とは、原子が結合していない状態の原子の一番外側の殻のことで、原子が関与するあらゆる反応の性質や他の原子との結合相互作用を説明する可能性が最も高い電子を含んでいます。イオンの一番外側の殻は、一般的に価電子殻とは呼ばれないことに注意しなければなりません。価電子殻内の電子は価電子と呼ばれています。
貴族ガスでは、原子はその外殻に8個の電子を持つ傾向があります(2個の電子でしかその外殻を満たすことができないヘリウムを除く)。これがオクテット則のモデルとなり、主に第2周期と第3周期の主群元素に適用されます。原子軌道に関しては、価電子殻の電子は単一のs軌道に2個、3つのp軌道にそれぞれ2個ずつ分布しています。
遷移金属を含む配位錯体の場合、価電子殻は、これらのs軌道とp軌道の電子に加えて、5つのd軌道に2個ずつ配された最大10個の電子で構成されており、このような化合物の完全な価電子殻は合計18個となります。これは18電子則と呼ばれています。
| 殻の中の電子の可能な数 1~5 | |
| シェル | 電子 |
| 1 | 2 |
| 2 | 8 |
| 3 | 18 |
| 4 | 32 |
| 5 | 32 |
| 6 | 18 |
| 7 | 8 |
サブシェル
電子サブシェルは、s、p、d、f、g、h、iなどの文字で識別され、方位量子数(l値)0、1、2、3、4、5、6などに対応しています。各シェルは、それぞれ2個、6個、10個、14個、18個の電子を保持することができ、各サブシェルには2(2l+1)個の電子を保持することができる。s'、'p'、'd'、'f'という表記は、観測された微細な構造に基づいて、スペクトル線を「シャープ」、「プリンシパル」、「ディフューズ」、「ファンダメンタル」のいずれかに分類するという、現在では信用されていないシステムに由来しています。最初の4種類の軌道が記述されたとき、それらはこれらのスペクトル線のタイプと関連づけられていましたが、他の名前はありませんでした。g'、'h'などの呼称は、以下のアルファベット順で導き出された。
質問と回答
Q:電子殻とは何ですか?
A:電子殻(主エネルギー準位)とは、原子の中で原子核の周りを回っている電子が存在する部分のことです。
Q:ある殻には何個の電子が入るのですか?
A:ある殻に入ることができる電子の数は2n2に等しい。
Q:ボーア模型では、電子はどうなっているのか?
A:ボーア模型では、電子は原子核の周りをある距離で周回し、その軌道が「殻」を形成しているとされています。
Q:この用語を発表したのは誰ですか?
A:ニールス・ヘンリック・ダビッド・ボーアによって発表された言葉です。
Q:原子の電子配置を構成しているのは何ですか?
A:電子の殻が原子の電子配置を構成しています。
Q:すべての原子は1つ以上の電子殻から構成されているのですか?
A:はい、すべての原子は1つ以上の電子殻を持っています。
Q:すべての電子殻は、さまざまな数の電子を持つのですか?
A: はい、すべての電子殻はさまざまな数の電子を持っています。
百科事典を検索する