原子軌道とは?定義と波動関数・量子数でわかる電子配置入門
原子軌道を図解でやさしく解説。波動関数・量子数で電子配置を基礎から理解し、周期表との関係まで学べる初心者向け入門ガイド。
原子軌道とは、原子の原子核の周りにある、ある時点で電子が最も多く存在する場所のことである。原子の中の1個の電子または1対の電子の波動的な振る舞いを記述する数学関数である。
「軌道」という言葉が使われているのは、原子核が太陽のように、電子が惑星のように軌道を回る太陽系に似た振る舞いをしていると考えられていたからです。しかし量子力学では、電子は決まった線のように回るのではなく、確率的に分布して存在します。
元素の原子軌道の数は、その元素が存在する周期によって定義されます。電子は、その移動速度と他の電子の数に応じて軌道間を移動します。
原子論や量子力学では、原子軌道は量子数である。このような軌道は、それぞれ1つまたは2つの電子で占有されます。軌道の配置は、原子の電子配置に関係しています。これらの軌道は、初期の分光学者がアルカリ金属のある種の分光学的な線をシャープ、プリンシパル、ディフューズ、ファンダメンタルであると説明したことに由来しています。
波動関数と確率密度
原子軌道は数学的には波動関数 Ψ(プサイ)で表されます。波動関数自体は複素数をとり、直接の物理量ではありません。観測される確率は波動関数の絶対値の二乗、|Ψ(r,θ,φ)|² によって与えられ、ある位置 r の微小体積に電子が存在する確率密度を表します。波動関数は正規化され、異なる軌道どうしは直交します。
量子数と軌道の種類
原子軌道は4つの量子数で特徴付けられます。要点は次の通りです:
- 主量子数 n(n = 1, 2, 3, ...):軌道のエネルギーの大きさと原子核からの大まかな距離(殻)を示す。各殻に含まれる軌道の総数は n² である。
- 方位量子数 l(l = 0, 1, ..., n−1):軌道の角運動量に対応し、軌道の形(s, p, d, f ...)を決める。l = 0 → s、1 → p、2 → d、3 → f。
- 磁気量子数 m_l(m_l = −l, ..., 0, ..., +l):軌道の空間配向(向き)を示す。例えば p 軌道は m_l = −1, 0, +1 の3つの向きを持つ。
- スピン量子数 m_s(m_s = +1/2 または −1/2):電子自身の固有角運動量(スピン)を表す。1つの軌道に入れる電子の上限がここから決まる。
軌道の占有と電子配置のルール
重要なルール:
- パウリの排他原理:同じ原子で全ての4つの量子数が全く同じ電子は存在できない。結果として1つの軌道には最大2個の電子(逆向きスピン)しか入らない。
- フントの規則:同じエネルギーの軌道(縮退した軌道)に電子を入れるときは、まずスピンを平行にしてそれぞれの軌道に1個ずつ入れ、次に対になるように入れる(最大多重度を保つ)。
- アウフバウ則(近似):電子は一般にエネルギーの低い軌道から順に占有する。多電子原子では軌道のエネルギー順位は単純な n によらず (n + l) などの規則で説明される場合がある。
軌道の形とノード
各軌道は特徴的な形を持ちます。代表例:
- s軌道(l = 0):球対称。中心に最大密度を持ち、主量子数が増えるごとに半径方向のノード(零点)を1つずつ増やす。
- p軌道(l = 1):双葉型(ダンベル型)。3つの方向(m_l = −1,0,+1)で配向が異なる。
- d軌道(l = 2):より複雑な形を持ち、空間に5つの向きがある。
ノードとは波動関数がゼロになる領域で、角ノード(形を分ける)と放射状ノード(半径方向のゼロ点)に分けられる。ノードの数は量子数に依存します。
水素原子と多電子原子の違い
水素原子(1電子系)ではシュレーディンガー方程式が解析的に解け、軌道は正確なエネルギー準位と形を持ちます。しかし多電子原子では電子間相互作用があるため厳密解は得られず、各種近似(ハートリー・フォック法、密度汎関数法など)で軌道やエネルギーが求められます。
実用的・化学的な意味
原子軌道は化学結合や分子の形、スペクトル線、化学反応性を理解するための基本概念です。例えば価電子軌道の種類や占有は元素の化学的性質(酸化数、結合数、配位性)を決めます。また、軌道の重なり(オーバーラップ)は共有結合の強さに直結します。
まとめ
原子軌道は単なる「電子の通り道」ではなく、電子の存在確率を記述する波動関数による空間分布です。量子数によって形、エネルギー、向きが定まり、各軌道は最大2つの電子で占有されます。水素原子では理論が単純に当てはまりますが、多電子系では近似が必要となり、これが周期表や化学的性質の理解につながります。
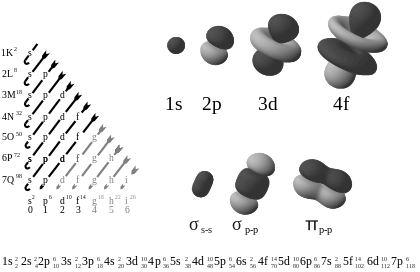
左の図は、エネルギーの高い順に軌道を示しています。右側は軌道の形状の例です。
関連ページ
- 電子雲
- 分子軌道
質問と回答
Q:原子軌道とは何ですか?
A:原子軌道とは、原子核の周囲にある、電子が最も見つかりやすい領域のことです。
Q: 原子の電子の振る舞いを表す数学的な関数は何ですか?
A: 原子の中の電子の振る舞いを表す数学的な関数は、波動関数です。
Q: なぜ「軌道」という言葉が使われているのですか?
A: かつて電子は太陽の周りを回る惑星のようなものだと考えられていたため、電子が最も多く存在する原子核の周囲を指す言葉として「軌道」という言葉が使われます。
Q: 元素の原子軌道の数はどのように定義されるのですか?
A: 元素の原子軌道の数は、元素の周期によって決まります。
Q: なぜ電子は軌道の間を移動するのですか?
A: 電子は、その速度と他の電子の数によって、軌道間を移動します。
Q: 原子論や量子力学における原子軌道とは何ですか?
A:原子軌道は、原子論および量子力学における量子数である。
Q: 各原子軌道は何個の電子が占有できるのですか?
A: 各原子軌道には、1個または2個の電子が存在します。
百科事典を検索する