周期表とは?化学元素の一覧と周期・グループの仕組みをやさしく解説
周期表とは何かを初心者向けにやさしく解説。化学元素の一覧、周期・グループの仕組み、性質の読み方やメンデレーエフの歴史まで図解で理解。
化学元素の周期表とは、既知の化学元素の一覧表です。周期表では、元素は原則として原子番号の低い順、すなわち核に含まれる陽子の数が少ないものから多いものへと並べられています(原子番号は原子の識別子のようなものです)。周期表は元素を周期(横の列)とグループ(縦の列)に分けて示します。周期表を横に横断する列はピリオド(周期)と呼ばれ、通常1から8まで番号が付けられます。ピリオド1には、水素とヘリウムという2つの元素しかありません。ピリオド2と3にはそれぞれ8個の元素があり、ピリオドが進むほど含まれる元素数は増えていきます。各ピリオドに含まれる元素は連続した原子番号を持ち、電子殻が順に埋まっていくことを反映しています。
グループ(族)と性質の類似
周期表の縦列はグループと呼ばれ、標準的な周期表には18のグループがあります。グループに属する元素は外側の電子配置、つまり価電子の数が似ているため、化学反応での振る舞いが似通っています。例えば、最右端の18族に属する元素はすべてほとんど反応しない希ガス(不活性ガス)であり、常温常圧で単原子の気体として存在します。一方、1族(アルカリ金属)は価電子が1個で、非常に反応性が高く水と激しく反応して水酸化物を作ります。
グループ番号の表記と国際規格
グループ番号の表記には歴史的に2通りあり、アラビア数字(1–18)とローマ数字を組み合わせた古い方式(A/B 系)が使われてきました。20世紀の多くの期間ではローマ数字表記が使われていましたが、1990年に国際純応用化学連合(IUPAC)は混乱を避けるためにアラビア数字(1–18)を標準とすることを決め、現在はこれが国際的な標準です。
周期表に見られる主な傾向(周期的性質)
周期表上には多くの規則的な変化(周期的傾向)が見られます。代表的なものを簡単に説明します。
- 原子半径:同じ周期では右へ行くほど小さくなり、同じグループでは下へ行くほど大きくなります。これは核電荷の増加と電子殻の増加による効果です。
- イオン化エネルギー:原子から電子を1個取り去るのに必要なエネルギーです。一般に周期の右側で大きく、グループの上側で大きくなります。
- 電気陰性度:原子が結合中に電子を引き付ける強さの指標で、周期の右上に向かって大きくなります(フッ素が最も大きい)。
- 金属性の傾向:周期表の左下に行くほど金属性が強く、右上に行くほど非金属的になります。これは電子の放出しやすさや結晶性などに表れます。
ブロック、ランタノイド・アクチノイド、超重元素
電子配置に基づいて周期表はs, p, d, fの「ブロック」に分けられます。dブロックは遷移元素、fブロックはランタノイド・アクチノイド(通常は周期表の下に別列で配置)に対応します。ランタノイド(57–71)とアクチノイド(89–103)はf軌道が徐々に埋まる系列で、多くが希土類元素や放射性元素を含みます。
20世紀後半以降、人工的に合成された超重元素(トランスアクチニド元素、原子番号104以降)も発見され、周期表は現在も拡張されています。これらの元素は寿命が非常に短いものが多く、名前は発見チームの提案とIUPACの承認で正式に決まります(例:元素101はメンデレーエフにちなみメンデレビウムと名付けられました)。
歴史:メンデレーエフと周期律
周期表を最初に体系的に整理したのは、ロシアの化学者がドミトリー・イヴァノビッチ・メンデレーエフ(1834–1907)です。メンデレーエフは元素を原子量順(現在の考え方とは違う指標)に並べる中で、性質が周期的に現れることを示し、空白を残して将来発見される元素の性質を予言しました。彼の予言は後に正しいことが示され、周期表の信頼性を高めました。これが「周期律(周期法則)」の始まりです。
周期表の読み方と活用例
周期表は元素の化学・物理的性質を予測するために使います。日常的な利用例は次の通りです。
- 化学反応の平衡や反応性の予想:どの元素が酸化されやすいか、還元されやすいかを判断できます。
- 材料選択:金属、非金属、半導体などの区分から用途に適した元素を選びます。
- 学習と教育:電子配置、価電子の数、結合性質(イオン結合・共有結合)を理解する基礎になります。
補足 — 注意点
・表記や配置の細部(例えば貴ガスの位置、水素の扱い、ランタノイド・アクチノイドの表示方法)は資料によって異なる場合があります。
・周期表は科学の進展とともに更新され続けています。新元素の発見や同位体の性質に関する知見が増えると、表示や命名に変更が生じることがあります。
周期表は単なる一覧表ではなく、原子構造と化学的性質の間にある深い関係性を視覚化した非常に強力な道具です。基礎を押さえておくと、元素や化合物の性質を直感的に予測できるようになります。
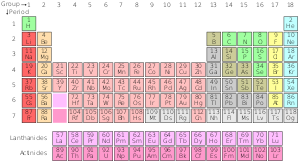
周期表の標準変動
標準周期表
| グループ→グループ | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 12 | 13 | 14 | 15 | 16 | 17 | ||||
| 1 | 2 | |||||||||||||||||||
| 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | ||||||||||||
| 3 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | ||||||||||||
| 4 | 19 | 20 | 21 | 22 | 23 | 24 | 25 | 26 | 27 | 28 | 29 | 30 | 31 | 32 | 33 | 34 | 35 | 36 | ||
| 5 | 37 | 38 | 39 | 40 | 41 | 42 | 43 | 44 | 45 | 46 | 47 | 48 | 49 | 50 | 51 | 52 | 53 | 54 | ||
| 6 | 55 | 56 | * ランタニド | 72 | 73 | 74 | 75 | 76 | 77 | 78 | 79 | 80 | 81 | 82 | 83 | 84 | 85 | 86 | ||
| 7 | 八十七フリ | 88 | ** アクチノイド類 | 104 | 105 | 106 | 107 | 108 | 109 | 110 | 111 | 112 | 113 | 114 | 115 | 116 | 117 | 118 | ||
| 8 | 119 上江 | 120 Ubn | *** スーパーアクチノイド | |||||||||||||||||
| * ランタニドシリーズ | 57 | 58 | 59 | 60 | 61 | 62 | 63 | 64 | 65 | 66 | 67 | 68 | 69 | 70 | 71 | |||||
| ** アクチニドシリーズ | 89 | 90 | 91 | 92 | 93 | 94 | 95 | 96 | 97 | 98 | 99 | 100 | 101 | 102 | 103 | |||||
| *** スーパーアクチニドシリーズ | 121 | 122 | 123 | 124 | 125 | 126 | 127 | 128 | 129 | 130 | 131 | 132 | 133 | 134 | 135 | |||||
| *** スーパーアクチニドシリーズ | 136 | 137 | 138 | 139 | 140 | 141 | 142 | 143 | 144 | 145 | 146 | 147 | 148 | 149 | 150 | |||||
| *** スーパーアクチニドシリーズ | 151 | 152 | 153 | 154 | 155 | 156 | 157 | 158 | 159 | 160 | 一六一 | 162 | 163 | 164 | 165 | |||||
| *** スーパーアクチニドシリーズ | 166 | 乙丑三つ | 168 | 169 | 170 | 171 | 172 | 173 | 174 | 175 | 176 | 177 | 百七十八 | 179 | 180 | |||||
| *** スーパーアクチニドシリーズ | 181 | 182 | 183 | 184 | 185 | 186 |
| 百八十八 | 十八九 | 一九九〇 |
| 192 | 193 | 194 | 195 | |||||
| *** スーパーアクチニドシリーズ | 196 |
| ウン十九十八 | 一九九九 |
| 201 | 202 | 203 | 204 | 205 | 206 | 207 | 208 | 209 | 210 | |||||
| *** スーパーアクチニドシリーズ | 211 | 212 | 213 | 214 | 215 | 二百六十六 | 217 | 218 | 219 |
| 221 | 222 | 223 | 二百二十四十四 |
| |||||
周期表の化学系列
- アルカリ金属
- アルカリ土類
- ランタニド
- アクチノイド類
- スーパーアクチノイド
- 遷移金属
- 貧弱な金属
- 非金属
- ハロゲン
標準温度、標準圧力での状態。元素記号の上の数字(原子番号)の色は、常温常圧での状態を表しています。
- 青は気体
- 緑は液体
- 黒一色
- 境界線がしっかりしているものは、安定した同位体(原始元素)を持っています。
- 破線で囲んだものは、自然界に存在する放射性同位体のみを含む。
- 点線のあるものは自然には存在しない(合成要素
- 国境のないものは放射能が強すぎてまだ発見されていません。
化学元素を表示する他の方法
上記の周期表のバージョンが最もよく使われています。他の普及しているバージョンを以下に示します。
· 
ドミトリー・イヴァノビッチ・メンデレーエフは、花の配置を使用しており、アクチニド、ランタニドは主なグループの横にループとして表示されます。
· 
ティモシー・ストーブは量子数で元素を並べた。
· ![]()
ベターマンは、多項式に変換できる等電点の特性で要素を配置しました。
· 
三角バージョン、ズマックジンスキとベイリーによる
· 
ピラミッドにアレンジ。
使用されているバージョンが少ない
関連ページ
- 周期表グループ
- 周期表の周期
- 拡張周期表
質問と回答
Q: 周期表とは何ですか?
A: 周期表は、すべての既知の化学元素を原子番号順に並べた表で、水素を1番とするものです。似たような性質を持つ元素同士は近くに配置されていることが多い。
Q: 標準周期表にはいくつの周期とグループがあるのですか?
A: 標準周期表には、8つの期間と18のグループがあります。
Q: 1つの周期に含まれる元素の共通点は何ですか?
A: 原子番号が連続する元素です。
Q: グループに含まれる元素の共通点は何ですか?
A: グループ内の元素は、価電子の数によって電子が同じように配置されているため、化学的性質が似ています。
Q: 周期表を発明したのは誰ですか?
A: ロシアの化学者ドミトリー・イワノビッチ・メンデレーエフ(1834-1907)が周期表を発明しました。
Q: 周期表の3つの主要なグループとは何ですか?
A: 周期表の3つの主要なグループは、金属、金属化合物、非金属です。
Q: 周期表を使って、元素間のパターンや関係をどのように観察することができるのか?
A: 周期表の左下にある元素は右上にある元素よりも金属的であるなど、元素間のパターンや関係は周期表のどの位置にあるかを見ることで観察できます。
百科事典を検索する
