エノールとは:定義・性質・エノラート、互変異性とアルドール反応入門
エノールとは何か、エノラート生成法、互変異性の原理と動的・熱力学的エノラート、実践的アルドール反応までを図解でわかりやすく解説。
エノールとは、二重結合の一端にOH基が結合しているアルケンのことです。酸素原子のプロトンが取り除かれたものをエノラートと呼ぶ。
定義と基本的な性質
エノールは、典型的にはケトンやアルデヒドと互変異性を示します。互変異性体とは、分子骨格は同じで、水素原子の位置だけが異なる分子のことを指します。エノールは酸素の孤立電子対とC=Cのπ結合による共鳴である程度安定化されますが、一般にC=O結合(カルボニル結合)の方が安定なため、単純なケトンの平衡は通常ケトン側に傾きます。
しかし、以下のような要因でエノール体の存在比が高くなることがあります:
- 共役(例えばアリル化されたエノール)による安定化
- 脱共役できない内在的な水素結合(例:1,3-ジカルボニル化合物、2,4-ペンタジオンのエノール型は内在的な水素結合・共鳴で非常に安定)
- 溶媒や酸・塩基触媒の影響
生成方法:酸触媒と塩基触媒
エノールは酸触媒・塩基触媒のいずれでも生成できます。塩基触媒では、まずケトンやアルデヒドのα位(カルボニルに隣接する炭素)の水素が引き抜かれてエノラートが生じ、それがプロトン化されてエノールになります。強塩基(例:LDA=リチウムジイソプロピルアミド)を用いると直接エノラートを安定に得られます。
酸触媒では、カルボニル酸素がプロトン化されて電気的に活性化され、続いてα位の水素が除かれてエノールが形成されます。酸触媒経路は一般に可逆で、平衡が速く移動します。
エノラート(enolate)の性質と反応性
エノラートは酸素上の負電荷とα炭素上の負電荷を共鳴的に分布させたアニオンです。したがって、エノラートは以下のような特徴を持ちます:
- α炭素が求核的になり、カルボニルやハロゲン、およびイミニウムなどの電気的に良好な求電子体に攻撃する(C-アルキル化、カルボニル付加など)。
- 酸素側が求核サイトになる場合もあり、特に硬い求電子体や酸無水体に対してはO-付加(O-アルキル化)が起こりやすい。
- 反応条件(溶媒・塩基・温度)により、C-付加かO-付加か、または異なる位置(どのα位が脱プロトンされるか)が選択される。
実用的には、エノラートを直接扱う代わりに、反応性を調節した保護型としてシリルエノールエーテル(例:TMSエノールエーテル)が用いられることが多いです。これにより選択的なアルキル化や酸化などが可能になります。
互変異性(ケト-エノール平衡)とその左右要因
一般に、単純なケトンではケト形の割合が大きいですが、次のような因子がエノール化を進めます:
- 共役や芳香族化(エノールのC=Cが芳香環に共役すると安定)
- 内在的水素結合(1,3-ジカルボニル系などで顕著)
- 溶媒効果・酸・塩基の存在(酸触媒でプロトン供与、塩基で脱プロトン)
- 置換効果(アルキルや電子供与基・吸引基がα炭素の酸性度を変える)
例えばアセトンのα水素のpKaは約19–20であり、強塩基があれば容易に脱プロトンしてエノラートになります。一方、2,4-ペンタジオンのような化合物はエノール形が非常に安定で、ほとんどエノール形で存在します。
動力学的エノラートと熱力学的エノラート
ケトン類のエノール(またはエノラート)は、どのα位の水素が除かれるかにより複数の異性体が生成する場合があります。ここで重要になるのが動力学的(kinetic)と熱力学的(thermodynamic)エノラートの区別です:
- 動力学的エノラート:反応が速く起こる方(置換基の少ない側のα位が脱プロトンされやすい)。低温(例えば−78 °C)・立体障害が大きい塩基(LDAなど)を用いると得やすい。生成が速く、不可逆に近い条件で捕捉される。
- 熱力学的エノラート:より安定な異性体(より置換が多く、共役が得られる側のエノラート)。高温や平衡に近い条件、弱塩基(アルコキシド等)で得られやすい。
この制御は、望ましい位置選択的アルキル化やアルドール反応の選択性に直結します。
アルドール反応の基礎
エノール/エノラートの最も重要な反応の一つがアルドール反応です。基本的な流れは次の通りです:
- 塩基やルイス塩(あるいは酸)によりエノラート(またはエノール)が生成される。
- 生成したエノラートのα炭素が別のカルボニル化合物のカルボニル炭素を求核的に攻撃する。
- 立体化学的に安定なβ-ヒドロキシカルボニルが生成し、条件によっては脱水してα,β-不飽和カルボニル化合物(縮合生成物)になる。
アルドール反応はC–C結合形成の代表的手法であり、分子構築に幅広く使われます。反応の選択性(自己縮合か交差縮合か、縮合の有無、立体化学など)は塩基の種類、溶媒、温度、エノラートの生成法で大きく左右されます。
実用上の注意点と応用例
- 立体化学の制御:エノラートの立体的性質(E/Z)や攻撃面の制御が重要。例えばアルドールでのシス・トランス選択は反応条件に依存。
- O-付加とC-付加:ハードな求電子体は酸素側に反応しやすく、柔らかい求電子体は炭素側に反応しやすい。反応条件で望まない副反応が起こることがある。
- トラッピング法:エノラートは反応性が高いため、反応中間体としてトラップ(例:TMSで保護)して望ましい変換を行うことが多い。
- 分析手法:エノールはIRでOH伸縮(約3200–3600 cm−1)やC=C伸縮、NMRではOHプロトンやα位置の化学シフトで検出できる。溶媒や温度で信号が変動する。
まとめると、エノールとエノラートは有機合成において非常に重要な中間体です。ケトンやアルデヒドからの生成、互変異性、動力学/熱力学制御、そしてアルドール反応などの応用を理解することで、選択的なC–C結合形成や機能化が可能になります。
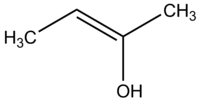
エノール
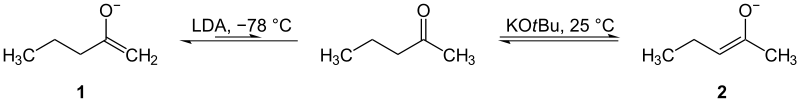
運動学的(1)および熱力学的(2)エノレート
質問と回答
Q: エノールとは何ですか?
A: エノールとは、二重結合の一端にOH基が結合したアルケンのことです。
Q:エノラートとは何ですか?
A:エノラートとは、酸素原子上のプロトンを取り除いたエノールです。
Q:互変異性体とは何ですか?
A:互変異性体は、水素原子の位置だけが異なる分子です。
Q: ケトンやアルデヒドからエノールを作るにはどうしたらよいですか?
A: エノールは、塩基を使ってケトンやアルデヒドから簡単に作ることができます。
Q: エノールはなぜ不安定なのですか?
A:エノールが不安定なのは、C=C結合よりもC=O結合の方が強いからです。
Q: アルドール反応とは何ですか?
A: アルドール反応は、エノールを使ってできる面白い反応です。
Q: エノールの置換基の少ない側はどのように反応させることができるのか?
A: kinetic enolateと呼ばれる置換基の少ないエノールの側を、嵩高い塩基を使って低温で作って反応させることができます。
百科事典を検索する