分子とは何か — 定義・構造・性質・分子式をやさしく解説
分子とは何かを初心者向けにやさしく解説。定義・構造・性質・分子式(例:C6H12O6)まで図解でわかりやすく紹介。
分子とは、存在しうる化学物質の最小量のことである。もし分子が細かく分かれていたら、それは別の物質になってしまいます。
分子の定義と用語の違い
一般的には、分子とは複数の原子から共有結合や配位結合などで結びついた、化学的に独立した最小の粒子を指します。ただし、文脈によって定義が変わることがあります。例えば、気体の運動論では単に気体の粒子を「分子」と呼ぶことが多く、この場合は一原子からなる希ガスの原子も分子として扱われます(単原子分子)。一方、イオン結晶(例:NaCl)や共有結合の巨大格子(例:ダイヤモンド)は「個別の分子」をもたないため、分子という言葉がそぐわない場合もあります。
原子の結びつきと価数(結合数)
分子は、特定の形や形でくっついている原子によって構成されます。原子同士の結合の仕方にはいくつか種類があり、代表的なものは共有結合とイオン結合です。
- 共有結合:電子対を共有して結びつく。多くの分子(有機分子や多くの非金属化合物)は共有結合で成り立ちます。
- イオン結合:電子の移動により陽イオンと陰イオンが静電引力で結びつく。典型的には塩類(例:NaCl)で見られますが、これらは「分子」とは呼ばれないことが多いです。
- 配位結合(配位共有結合):一方の原子(または分子)が電子対を提供して結合する。
原子は異なる価数(通常は結合できる数)を持ちます。たとえば、酸素原子は典型的には2つの結合を取ります(単結合2個、または二重結合1個など)。炭素原子は通常4つの結合、窒素は通常3つの結合を形成します。ただし、これはあくまで「典型的な」振る舞いであり、酸化数や周囲の電子環境により複数の結合様式をとることがあります(酸素の−1価や+2価など、窒素の四価化など)。
分子の形(立体構造)と性質
分子の性質は、原子の種類だけでなくその形(立体配置)にも大きく依存します。立体構造は結合角や結合長、電子対反発(VSEPR理論)などで決まります。例:
- 水(H2O)は折れ線形で極性分子。これにより水素結合が生じ、水の高い沸点や溶媒性などの特性が出ます。
- 二酸化炭素(CO2)は直線形で全体としては無極性(ただしC=O結合自体は極性)。
- 炭素骨格に依存する有機分子では、同じ組成でも結合のつなぎ方・立体配置(立体異性)で性質が大きく変わります。
物質の状態と分子の運動
空気のような気体では、分子はほとんど互いに衝突しながら自由に飛び回っています(気体分子運動)。水のような液体では、分子は互いに引き合いながらも相対移動ができ、流動性を示します。砂糖のような固体では分子は規則的に配列され、主に振動することしかできません。プラズマと呼ばれる第四の物質の状態では、原子は高エネルギーによりイオン化していて分子を形成することができません。
分子式・構造式・実験的な表記
分子式は分子内の各元素の原子数を表します。例:グルコースの分子式はC6H12O6で、1分子は炭素6個・水素12個・酸素6個から成ることを示します。しかし分子式だけでは原子の結びつきや立体配置は分かりません。
- 分子式(分子の組成):C6H12O6(グルコース)
- 実験式(経験式):最小整数比で表した式。例:過酸化水素はH2O2で、経験式も同じ。
- 構造式:原子の結合関係を示す。線や立体表現で分子の形が分かる。
- イオン式:電荷を持つ場合はその電荷も表記(例:NH4+)。
分子量(正確には分子質量)やモル質量は、分子式から計算できます。例えばグルコースのモル質量は約180.16 g·mol−1(C:12.01×6 + H:1.008×12 + O:16.00×6 の合計)です。さらに同位体(例:炭素12と炭素13)の存在により平均質量は変わります。
分子間力と物性
分子の集合体としての性質(融点・沸点・溶解性・粘性など)は、分子間に働く力(分子間力)によって決まります。主要な分子間力:
- ロンドン分散力(ファンデルワールス力):すべての分子に働く瞬間的な双極子による引力。分子の大きさ・極性可塑性に依存。
- 双極子−双極子相互作用:永久双極子を持つ分子同士の引力。
- 水素結合:H−X(X = O, N, F など)の結合で強く現れる方向性のある引力で、特に水の高い沸点や生体分子の構造維持に重要。
単原子・二原子・高分子・格子との違い
分子という概念は「離散した粒子」を想定しますが、すべての物質がこの形を取るわけではありません。例:
- 単原子分子:希ガスの原子(気体力学では分子と見なす)。
- 二原子分子:H2, O2, N2など。
- 高分子(ポリマー):多数の単位が共有結合で連結された巨大分子(例:ポリエチレン)。一つの「分子」として扱えるがサイズが非常に大きい。
- 共有結合網状固体:ダイヤモンドや二酸化ケイ素(SiO2)など、個々の「分子」がなく巨大な格子構造を作るため、分子という言い方が適当でない。
化学反応と分子
化学反応は原子の再配置による分子の結合の切断と形成です。分子の安定性・反応性は結合エネルギー、電子配置、立体障害、官能基などに依存します。ラジカル(不対電子を持つ種)やイオンは通常の共有結合から生成され、反応性が高いです。
まとめ
分子は、化学物質の最小の独立した粒子であり、原子の種類とその結合の仕方(構造)によって性質が決まります。分子式は組成を示す一方、構造式や立体配置は物性や反応性を理解する上で不可欠です。また、気体力学や材料化学では「分子」の扱い方が状況により異なるため、文脈を踏まえた理解が必要です。
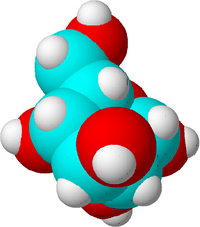
これは糖の分子です。炭素原子を青、酸素原子を赤、水素原子を白にして違いを表しています。実際には原子には色がありません。
ボンディング
分子が存在するためには、原子がくっついていなければなりません。これは、2つの原子が電子を共有しているときに起こります。電子は1つの原子の周りを回るのではなく、2つの原子の周りを回るようになります。これを共有結合といいます。場合によっては、複数の電子が共有されていることもあります。電子を共有する数が多いほど、結合が強くなり、原子がくっつく力が強くなります。
結合はまた、バラバラにすることができます。ほとんどの結合は形成にエネルギーを必要とするので、結合が壊れるときにもエネルギーを放出します。しかし、ほとんどの結合が壊れる前に、分子を加熱する必要があります。その後、原子が動き始め、彼らがあまりにも多く移動すると、結合が壊れます。このように、壊れたときに放出するエネルギーよりも、壊すのに必要なエネルギーが少ない分子を燃料と呼びます。例えば、ろうそくはそこに座っているだけで何も起こりません。しかし、マッチを使って火をつけると、長い間燃え続けます。マッチは、ロウソクが燃え尽きるまで、その下の結合を壊すのに十分なエネルギーを放出する最初の結合を壊すためのエネルギーをもたらします。
イオン結合もあります。
質問と回答
Q:分子とは何ですか?
A: 分子とは、ある化学物質の可能な限り小さな量のことです。原子が特定の形にくっついたものである。
Q:酸素原子、炭素原子、窒素原子は何個の結合を持っているか?
A: 酸素原子は常に他の原子と2つの結合を、炭素原子は常に他の原子と4つの結合を、窒素原子は常に他の原子と3つの結合を持っています。
Q:気体の運動論は、分子についてどのように言っているのですか?
A:気体の運動論によれば、気体の粒子はその組成にかかわらず、すべて分子という用語がよく使われます。つまり、希ガス原子は、実際には単原子分子であるため、分子とみなされる。
Q:分子は状態によってどのような振る舞いをするのでしょうか?
A:空気のような気体では、分子はただ飛び回っているだけです。水のような液体では、分子は互いにくっついていますが、それでも動き回ることができます。砂糖のような固体では、分子は振動することしかできない。プラズマ(物質の第4の状態)では、原子は電離し、分子を形成することができない。
Q:分子式は何ですか?
A:分子式は、分子を構成するすべての原子の数を書き表すのに使われます。例えば、C6H12O6は、6個の炭素原子、12個の水素原子、6個の酸素原子からなるグルコース1分子を意味する。
百科事典を検索する