水素の同位体とは|プロチウム・重水素・トリチウムの定義と特徴
水素の同位体(プロチウム・重水素・トリチウム)の定義と特徴をわかりやすく解説。性質・安定性・放射性や利用例まで基礎から詳述。
水素には、プロチウム(1H)、重水素(2H、記号:D)、トリチウム(3H、記号:T)という3つの主要な同位体がある。これらは自然界にも存在し、原子核の中の陽子と中性子の数が異なることで区別される。具体的には、プロチウムは陽子1個・中性子0個、重水素は陽子1個・中性子1個、トリチウムは陽子1個・中性子2個を持つ。プロチウムと重水素は安定核種であり、自然界での存在比はプロチウムが約99.985%(原子当たり)、重水素が約0.015%(約156 ppm)と非常に偏っている。トリチウムは放射性物質で、自然には極微量しか存在せず、主に宇宙線相互作用や人工的な核反応で生成される。トリチウムの半減期は約12.3年で、ベータ崩壊によりヘリウム-3に変わる。
名前と表記の扱い
これらの主要な同位体は、固有の名前(プロチウム、重水素、トリチウム)を持つ点でユニークであり、日常的にもよく使われる。しかし、国際純正・応用化学連合(IUPAC)は、慣用名よりも質量数を付した表記(例:1H、2H、3H)の使用を推奨している。化学・物理学の分野では、重水素をD、トリチウムをTと略記することが多く、特に同位体化合物(D2O=重水など)の表記で見られる。歴史的に放射能研究の初期には、同位体に独自の呼称が与えられていたものもあるが、現在は一般的に使われていない。
物理化学的な違いと応用
同位体は電子配置が同じであるため化学的性質は似ているが、質量差により物理的および動力学的性質に明確な違いが現れる。重水素を含む化合物は質量が大きいため、結合振動数が低くなり、反応速度に影響を与える(同位体効果)。代表例として、重水(D2O)は普通の水(H2O)より密度や沸点が高いため、原子炉で減速材として使われることがある(重水炉)。
- 重水素(D):化学や生化学でトレーサーとして用いられる。核磁気共鳴(NMR)では溶媒のバックグラウンド信号を抑えるために用いられることがある。
- トリチウム(T):核融合燃料(D–T反応)や放射標識(トレーサー)、発光塗料(低レベルのベータ線を利用)などに利用される。放射性のため取り扱いと廃棄には規制がある。
トリチウムの生成と安全性
トリチウムは宇宙線と大気中の核反応、あるいは原子炉や加速器での核反応によって生成される。工業的にはリチウムへの中性子照射などで生成されることがある。トリチウムが放出するベータ線はエネルギーが低いため皮膚透過性はほとんどないが、体内に取り込まれた場合は内部被曝につながるため、飲料水や環境への放出管理が重要である。
その他の同位体(4H〜7H)
科学者たちはさらに4つの水素同位体(4H〜7H)を人工的に合成したが、これらは非常に不安定で寿命が極めて短く、自然界には存在しない。これらの同位体は励起準位や共鳴状態として生成され、主に中性子放出や速い崩壊を通じて崩壊するため、実用的な用途はほとんどない。
要点まとめ:
- 水素の主要同位体はプロチウム(1H)、重水素(2H、D)、トリチウム(3H、T)。
- プロチウムと重水素は安定、トリチウムは放射性で半減期は約12.3年。
- 重水素は重水として物性が変わり、トレーサーや原子炉の減速材などに利用される。トリチウムは核融合燃料や放射標識に使われるが、取扱いに注意が必要。
- 高質量側の同位体(4H〜7H)は人工的に作られるが非常に不安定で自然には存在しない。
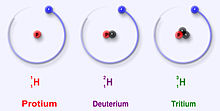
最も安定した水素の3つのアイソトープ
プロチウム(水素-1)
プロチウムは、水素の中で最も多い同位体です。宇宙に存在する水素の99.98%以上を占めています。原子核に陽子が1個しかないことから、プロチウムと名付けられました。原子質量は1.00782504(7)uです。プロチウムの陽子は観測では一度も崩壊していないので、科学者はプロチウムが安定した同位体であると考えている。素粒子物理学の新しい理論では、陽子が崩壊することが予測されているが、この崩壊は非常に遅い。陽子の半減期は1036年と言われています。もし陽子の崩壊が本当なら、安定していると言われている他のすべての原子核は、実は観察上安定しているだけ、つまり安定しているように見えるだけなのです。最近の実験では、もし陽子崩壊が起こるとすれば、その半減期は6.6×1033年になるという。
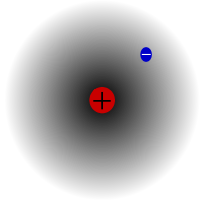
水素の最も一般的な同位体であるプロチウム。中性子を持たない唯一の同位体であるため、特別な存在である。
重水素(水素-2)
重水素(2HまたはD)は、水素の安定同位体の一つである。この同位体は、1つの陽子と1つの中性子を持っている。地球上の水素原子の約0.0026~0.0184%を占めています。重水素は、地球上の水素ガスには少なく、海水に多く含まれている(0.015%、150ppm)。重水素は放射性物質ではなく、生物に害を与えることはありません。重水素は水分子を形成することもできる。プロチウムの代わりに重水素を持つ水は重水と呼ばれています。
トリチウム(水素-3)
トリチウム(3H)は、水素の中で最も安定した放射性同位体である。つまり、水素の放射性同位体の中で、トリチウムは最も放射性が低い。トリチウムは、原子核内に陽子1個と中性子2個を持っています。トリチウムはβマイナス崩壊して、ヘリウム3に変化する。半減期は12.32年である。トリチウムは、大気上層部のガスと宇宙線の相互作用によって自然に生成される。また、核兵器の実験でも生成されます。トリチウムと重水素は、星のD-T核融合で使われ、大量のエネルギーを放出します。
質問と回答
Q: 水素の主な同位体はいくつあるのですか?
A:水素の主な同位体は、プロチウム、重水素、三重水素の3つです。
Q: プロティウムと重水素は安定な同位体ですか?
A:はい、プロトニウムと重水素は安定した同位体です。
Q: トリチウムの半減期は何年ですか?
A: トリチウムは放射性物質で、半減期は約12年です。
Q: 科学者は他に何種類の水素同位体を作ったのですか?
A: 科学者は4つの水素同位体(4H~7H)を作り出しました。
Q: これら4つの水素同位体は天然に存在するのですか?
A: いいえ、これらの同位体は非常に不安定なため、自然には存在しません。
Q:水素の主な同位体にはどのような特徴があるのですか?
A:水素の主要な同位体は、名前を持つ唯一の同位体であるため、ユニークです。
Q: 重水素と三重水素にはそれぞれ記号があるのですか?
A:はい、重水素と三重水素は独自の記号を持つことがあります: しかし、国際純正・応用化学連合は、よく使われているにもかかわらず、これらの名称をあまり好まないようです。
百科事典を検索する