孤立電子対(ローンペア)とは?定義・性質・反応での役割と分子形への影響
孤立電子対(ローンペア)の定義・性質・反応での役割や分子形への影響を図解と具体例でわかりやすく解説します。
ローンペアとは、原子間の結合に使用されない2個の電子のグループのことです。通常はその原子の最外殻、すなわち価電子帯に存在し、結合に使われる電子と合わせてその原子の価電子数を構成します。非結合電子(孤立電子対)は、結合電子よりもエネルギーが高い非結合軌道に局在しており、反結合軌道ほど高いエネルギーではありません。
基本的な性質
- 数と配置:典型元素では、酸素は通常2対、窒素は1対、ハロゲン原子は3対のローンペアを持ちます(例:H2Oでは酸素に2対、NH3では窒素に1対)。
- 軌道局在性:ローンペアは原子の軌道(hybrid軌道や純粋なp軌道など)に局在します。分子内の結合様式や共鳴(共役)によっては、ローンペアが複数の原子にわたって非局在化(分散)することがあります。
- エネルギーと反応性:非結合電子は結合電子より高エネルギーであるため、化学反応で比較的反応性を示します。特にプロトンや親電子(electrophile)を攻撃する際の電子供与源になります。
- 形式電荷とオクテット則:ローンペアの有無や数はルイス構造の形式電荷を決め、オクテット則(またはそれに類する安定化規則)に関係します。
反応での役割
ローンペアは化学反応において重要な役割を果たします。たとえば、分子同士が結合を作るとき、ローンペアは新しい結合の電子供与源になりえます。典型的には、求核剤は、自らのローンペアを用いて親電子を攻撃します(例:NH3がH+を受け取ってNH4+になる、あるいはNH3が金属イオンに配位する)。このようにローンペアはLewis塩基(電子対供与体)として振る舞います。
- 求核性と塩基性:ローンペアが自由に使えるほど求核性・塩基性は高くなりますが、共鳴で非局在化しているローンペアは反応性(特に塩基性)が低くなります(例:アニリンやアミドでは窒素の孤立電子が共鳴で分散し、塩基性は低下する)。
- 配位結合の形成:金属錯体では配位子のローンペアが金属中心に供与され、配位結合が形成されます(例:NH3やH2Oが遷移金属に配位)。
- 求核剤の選択性:ローンペアの局在度や軌道方向性が攻撃の位置や立体選択性に影響を与えます。
分子形(立体配座)への影響
ローンペアは結合電子対よりも空間を占めるため、分子の形を大きく変えます。VSEPR(価電子対反発)理論では、電子対同士の反発が分子形を決める主要因となります。重要な点は次のとおりです。
- 反発の強さの順序:孤立電子対–孤立電子対 > 孤立電子対–結合電子対 > 結合電子対–結合電子対。このため、孤立電子対の多い分子ほど結合角は小さくなります。
- 具体例:CH4(三角錐ではなく正四面体)の結合角は109.5°、NH3(窒素に1対の孤立電子対)は約107°、H2O(酸素に2対の孤立電子対)は約104.5°と、孤立電子対の増加に伴って結合角が小さくなる傾向があります。
- 軌道占有と方位性:孤立電子対が占める軌道の種類(sp3, sp2, pなど)や方向性は、分子内の結合角・平面性・回転障壁にも影響します。例えば、カルボニル酸素はしばしばsp2混成軌道にあり、ローンペアの向きが共鳴や反応性に関係します。
共鳴・電子供与・水素結合への影響
- 共鳴(非局在化):ローンペアが隣接するπ系に共鳴すると、局在した場合に比べて反応性や塩基性が低下します(例:アミドの窒素の孤立電子対はC=Oとの共鳴で非局在化され、塩基性が低い)。一方で、共鳴により陰イオンが安定化されると酸性度が増すこともあります(例:酢酸の共役塩基の安定化)。
- 水素結合:酸素や窒素などの孤立電子対は水素結合の受容体として機能します。これにより沸点・融点・溶解性・生体分子の立体構造(タンパク質の二次構造など)に大きな影響を与えます。
- 分極と分子間相互作用:ローンペアは局所的な負電荷を作るため、分子の双極子モーメントや分子間力(例:誘起双極子、静電相互作用)にも寄与します。
具体例と実用的ポイント
- 水(H2O):酸素に2対のローンペアがあり、水分子の105°付近の結合角や強い水素結合性を説明する。
- アンモニア(NH3):窒素に1対のローンペアがあり、塩基としてH+を受け取りやすい(配位子として金属に結合する例も多い)。
- アミド(—CONH—):窒素のローンペアがC=Oに共鳴しているため、塩基性が弱く、平面構造を取りやすい(部分的にsp2混成化する)。
- ハロゲン化物イオン(Cl−, Br−など):孤立電子対を持ち、高い求核性と塩基性を示す(溶媒やサイズに依存)。
まとめ
- ローンペアは結合に関与しない非結合電子対であり、原子の価電子を構成する重要な要素です。
- 分子の立体構造(結合角や配座)、化学反応性(求核性・塩基性・配位能)、物性(沸点・水素結合性)などに大きな影響を与えます。
- 共鳴や軌道の混成、局在/非局在化の度合いによってその働き方は変わるため、具体的な分子では電子構造を考慮して性質を予測することが重要です。
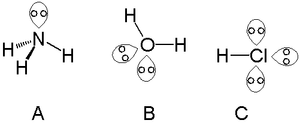
アンモニア(A)、水(B)、塩酸(C)中の孤立ペア
百科事典を検索する