親電子体(求電子種)とは|定義・性質・反応例と求核剤との関係
親電子体(求電子種)の定義と性質をわかりやすく解説、反応例や求核剤との関係を図解や具体例で紹介して有機反応やルイス酸の理解を深める入門ガイド
化学では、親電子体とは、他の分子から電子を喜んで受け取る分子または原子のことである。親電子体の多くは正の電荷を帯びている。ルイス酸とも呼ばれる。親電子分子の例としては、HClやカルボニルなど、原子の電気陰性度が大きく異なる分子や、酸化剤などがあります。
親電子体(求電子種)の性質
- 正電荷や部分正電荷:カルボカチオン(R3C+)やプロトン(H+)のように正電荷を持つものは強い親電子体です。部分正電荷は、電気陰性度の差や極性結合により生じます(例:Cδ+–Clδ-)。
- 空の軌道を持つこと:空の低いエネルギーの軌道(例えばカルボカチオンの空のp軌道、ホウ素の空のp軌道)は電子を受け取りやすく、親電子性が高いです。
- 共鳴や誘起効果:電子供与性置換基が付くと親電子性は低下し、電子求引性置換基が付くと増大します。共鳴による安定化は系の反応性に影響します(例:アシリウムイオンは共鳴安定されるため反応性が変わる)。
- 硬さ・軟らかさ(HSAB):硬い親電子体(例:H+, BF3)は硬い求核剤(OH-, F-)を好み、軟らかい親電子体(例:四級アルキルカチオン、I2による生成種)は軟らかい求核剤(I-, RS-など)を好みます。
主な親電子種の例
- プロトン(H+)や酸(HCl、H2SO4など)
- カルボカチオン(R3C+)やアシリウムイオン(R–C≡O+)
- カルボニル化炭素(C=Oの炭素、部分正電荷あり)カルボニルなど
- ハロゲン化試薬で生成するハロニウムイオンや電子不足のハロゲン分子
- 電子求引性の中心を持つ分子(例:硝基置換体、アシルハライド)
- 酸化剤として働く分子(電子を取り込みやすい)
反応例と機構
- 付加反応( electrophilic addition ):アルケンのπ結合は求核的に振る舞い、親電子体(H+, Br+, etc.)に攻撃されると中間体(カルボカチオンやブロモニウムイオン)が生じ、続いて求核剤がこれを捕捉します。元の文章にあるように、付加反応でよく観察される。
- 求電子置換反応(EAS:芳香族求電子置換):ベンゼン環などが親電子体により一時的に付加(σ-複合体)し、その後脱プロトンで芳香性を回復して置換体を与える。求電子体の強さと置換基の影響で位選択性が決まる。
- 求核置換(SN1):離脱基が脱離してカルボカチオンが生成し、これが親電子種として求核剤に攻撃される例。SN2では遷移状態で電荷移動が起きるが、ある意味で求電子的な炭素が求核剤に攻撃される反応である。
- アシル化・求電子付加-脱離:アシルハライドや酸無水物のカルボニル炭素は親電子的で、アミンやアルコールなどの求核剤に攻撃されて置換や付加が起きる。
求電子性を左右する要因(実用的ポイント)
- 電荷:正電荷があるほど親電子性は高い。
- 電子求引性置換基:隣接する電子求引基は中心の親電子性を高める。
- 共鳴安定化:共鳴で正電荷が分散する場合、反応性は低下することがある(安定化 = 反応性低下)。
- 溶媒効果:極性溶媒は電荷を安定化し、反応機構(SN1 vs SN2)や速度に影響する。
- 立体障害:親電子サイトが立体的に遮られていると求核剤の接近が妨げられ、反応性が低下する。
求核剤との関係(攻撃と選択性)
親電子は、その反対側の分子である求核に攻撃される。求核剤は電子対を提供して親電子中心に結合を形成する。反応の速さや生成物の選択性は、親電子性と求核性の強さ、溶媒、温度、立体環境、HSABの相性などで決まります。
測定指標・理論的な扱い
- 化学反応学では経験的な反応速度や位置選択性で親電子性を評価することが多いです。
- 理論化学では、パールの親電子性指標(electrophilicity index ω)など、電子化学的なパラメータを使って定量化する方法もあります(やや専門的)。
予測のコツ(実務向け)
- 結合の極性を見て、部分正電荷がある炭素や原子を探す(例:C=Oの炭素、C–XでXが電気陰性元素のときのC)。
- 正電荷や空の軌道があるか確認する(カルボカチオン、ボロンなど)。
- 置換基の電子供与性・求引性、共鳴効果を考慮して反応性と位選択を予測する。
- HSAB則を用いると、どの求核剤が有利かの目安になる。
以上を踏まえると、親電子体は「電子を受け取りやすい(電子不足な)部位または種」と理解でき、具体的な反応機構や生成物の選択性を予測するための重要な概念です。
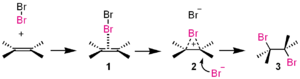
この付加反応では、臭素(Br2 )が求電子剤となります。
質問と回答
Q: 親電子物質とは何ですか?
A: 親電子とは、他の分子から電子を奪うことを喜ぶ分子や原子のことです。
Q: なぜ親電子はルイス酸とも呼ばれるのですか?
A: 親電子は他の分子から電子のペアを受け取ることができるので、ルイス酸とも呼ばれます。
Q: 親電子の例をいくつか挙げてください。
A: 親電子の例としては、HClやカルボニルのように、原子の電気陰性度が大きく異なる分子や、酸化剤があります。
Q: 求核剤は求電子剤とどのように反応するのですか?
A: 求核剤は求電子剤を攻撃することによって反応する。
Q: 求核剤とは何ですか?
A: 求核剤とは、求電子剤とは正反対の分子である。電子の供与を喜ぶ分子や原子のことである。
Q: 求電子剤と求核剤の間では、どのようにして付加反応が起こるのですか?
A: 求電子剤と求核剤の間で付加反応が起こるのは、求核剤が求電子剤を攻撃し、新しい結合を形成するときです。
Q: 求電子剤は負の電荷を持つことができますか?
A: 求電子剤は正の電荷を持つことができるが、部分的に正の電荷を持つことも、全く電荷を持たないこともある。重要な特徴は、電子を喜んで受け入れることです。
百科事典を検索する