求核剤(親核剤)とは|定義・性質・反応機構と代表例をやさしく解説
求核剤(親核剤)の定義・性質・反応機構をやさしく図解で解説。代表例や反応のポイントも初心者向けに理解できる。
親核剤とは、反応の際に電子ペアを求電子剤に提供して化学結合を形成する種のことである。電子のペアが空いている分子やイオンはすべて求核剤になりうる。この電子対はローンペアと呼ばれる。求核剤は電子を供与するので、ルイス塩基の定義に合致する。
親核性(求核性)とは
親核性(nucleophilicity)は、求核剤が正または部分的正電荷をもつ中心(核)にどれだけ速く付加・攻撃できるかを示す性質で、しばしば「求核剤の強さ」と呼ばれる。英語の Nucleophilic は「核(正電荷)に引き寄せられる」を意味する。
求核性に影響する主な要因
- 電荷:負に帯電した種(例:OH−, I−)は同じ原子で中性種より一般に求核性が高い。
- 電気陰性度:同じ周期なら電気陰性度が低い原子の方が電子を供与しやすく求核性が高い。
- 極性化能(偏極性):大きな、柔らかい陰イオン(例:I−, RS−)は極性化しやすく、しばしば良い求核剤となる(特にソフトな求電子中心に対して)。
- 立体障害(立体効果):分子が大きくてかさばると、反応点への到達が妨げられ求核性は低下する(例:tert‑butoxideは塩基性は高いが求核性は低い)。
- 共鳴や分極による安定化:電子が共鳴で分散していると求核性は低下する(例:フェノキシドは共鳴で安定化されるため求核性は下がる)。
- 溶媒効果:溶媒が求核性に強く影響する。プロトン性溶媒(例:水、アルコール)は小さな陰イオンを溶媒和させて求核性を低下させる一方、極性非プロトン性溶媒(例:DMSO、DMF)は求核性を高める場合がある。
求核性と塩基性の違い
塩基性はプロトン(H+)を引き抜く能力を示すのに対し、求核性は求電子中心に付加する能力を示す。両者は関連しているが同一ではない。例えばフッ化物イオン(F−)は塩基性は強いが、プロトン性溶媒中では溶媒和により求核性が低下し、ヨウ化物イオン(I−)の方が求核剤として強い場合がある。
反応機構:SN2 と SN1 の違い
- SN2(求核性置換、単分子求核置換):求核剤が基質の反対側から背面攻撃して同時に脱離基が離れる一段階反応。求核剤の強さ、立体障害、溶媒の影響が大きい。立体化学は反転(ワルデン反転)を示す。一次ハロアルキルやメチル基で起こりやすい。
- SN1(非同時置換、二段階反応):まず脱離基が離れてカルボカチオン中間体ができ、その後に求核剤が付加する二段階反応。求核性よりも基質の安定性(カルボカチオンの安定性)や溶媒の安定化が重要。三級ハロアルキルで起こりやすい。
ソルボリシス(溶媒による求核反応)
アルコールや水などの溶媒との中性求核反応を「ソルボリシス」と呼ぶ。ソルボリシスでは溶媒分子自体が求核剤として作用することがあり、溶媒の極性やプロトン供与能が反応速度と選択性に大きく影響する。たとえば、溶媒が極性かつプロトン性ならSN1反応が促進されやすい。
代表的な求核剤と代表例
- 無機陰イオン:OH−, OR−(アルコキシド), CN−, NH3/アミン類, RS−(チオラート), ハロゲン化物イオン(Cl−, Br−, I−)
- 有機陰イオンやカルボアニオン:エノレート、アルキルリチウムやグリニャール試薬(これらは非常に強い求核剤かつ塩基)
- 還元剤としての求核剤:NaBH4やH−源(ヒドリド付加でカルボニルに求核付加)
代表的反応例:
- ハロアルカンとCN−のSN2反応:アルキルハライド + CN− → ニトリル(R–CN)
- 三級ハロアルキルの水によるソルボリシス(SN1):tert‑BuCl + H2O → tert‑BuOH
- カルボニルへの求核付加:アルデヒド・ケトンに対するアルコキシドやヒドリドの付加(アルコール生成や還元)
- マイケル付加:α,β不飽和カルボニル化合物への求核付加(カルボアニオンやチオラートなど)
実務上の注意点・選び方
- 目的の反応機構(SN1かSN2か)に合わせて求核剤、溶媒、温度を選ぶ。
- 求核剤が強塩基である場合、脱プロトン化(E2など)などの副反応を起こすことがある。
- 溶媒和や立体障害、共鳴安定化などを考慮すると、実際の挙動は単純な理論だけでは予測しにくいことがある。
- 強い求核剤や水に敏感な試薬は取り扱いに注意(乾燥や不活性ガス下での操作が必要)
まとめ
求核剤は電子対(ローンペア)を提供して電子不足の中心に結合を作る種で、求核性は電荷、電気陰性度、極性化能、立体障害、溶媒など多くの因子で決まる。反応機構としてはSN2とSN1が基本で、溶媒によるソルボリシスや求核付加反応も重要である。具体的な反応計画では、求核剤の性質と反応条件を総合的に考えることが重要である。
沿革
1925年にA.J.Lapworthが提唱した「カチオン性物質」と「アニオン性物質」に代わり、1929年にChristopher Kelk Ingoldが「求核剤」と「求電子剤」という言葉を提唱した。
nucleophileという言葉は、nucleusとギリシャ語のφιλος、philos(愛)に由来しています。
プロパティ
一般に、周期表の一列の中では、塩基性のイオン(共役酸のpKaが高い)ほど求核剤としての反応性が高くなります。あるグループでは、求核性の決定には分極性がより重要であるとされています。言い換えれば、原子や分子の周りの電子雲を歪ませやすいほど、反応しやすくなる。例えば、ヨウ化物イオン(I)は−フッ化物イオン(F−)よりも求核性が高い。
求核剤の種類
求核剤の例としては、Clなどの−陰イオンや、NH3(アンモニア)などの孤立電子対を持つ化合物が挙げられる。
下の例では、水酸化物イオンの酸素が電子ペアを提供して、ブロモプロパン分子の末端の炭素と結合します。そして、炭素と臭素の結合は異種分解分裂を起こし、臭素原子が供与された電子を受け取り、臭化物イオン(Br−)となる。これはSN2反応がバックサイドアタックによって起こるものである。つまり、水酸化物イオンは、臭素イオンのちょうど反対側にある炭素原子を裏側から攻撃する。このバックサイドアタックのため、SN2反応では求電子剤の配置が逆転する。もし求電子剤が不斉であれば、通常、その不斉は維持されるが、SN2生成物の配座は元の求電子剤の配座とは逆転する(Walden反転)。
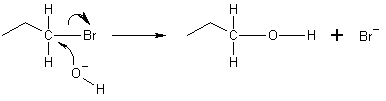
両性求核剤とは,2つ以上の場所からアタックして,2つ以上の生成物を得ることができる求核剤のことである。このため、アルキルハライドとSCNのSN2反応では、RSCN(アルキルチオシアナート)とRNCS(アルキルイソチオシアナート)の混合物が生じること−が多い。コルベニトリル合成でも同様の混合物が起こる。
カーボン求核剤
アルキル金属ハロゲン化物は、グリニャール反応、ブレーズ反応、リフォーマツキー反応、バルビエ反応、有機リチウム試薬、末端アルキンのアニオンなどに見られる炭素求核剤です。
エノールは炭素求核剤でもある。エノールの生成は、酸または塩基によって触媒されます。エノールは両性求核剤ですが、一般的には二重結合を持つ炭素の隣の炭素原子(α炭素原子)に求核性を示します。エノールは、クライゼン縮合反応やアルドール縮合反応などの縮合反応によく用いられる。
酸素求核剤
酸素求核剤の例としては、水(2HO)、水酸化物アニオン、アルコール、アルコキシドアニオン、過酸化水素、カルボン酸アニオンなどがあります。
硫黄の求核剤
硫黄の求核剤としては、硫化水素とその塩、チオール(RSH)、チオラートアニオン(RS−)、チオールカルボン酸のアニオン(RC(O)-−S)、ジチオカルボン酸のアニオン(RO-C(S)-S−)、ジチオカルバミン酸のアニオン(2RN-C(S)-S−)などがよく使われます。
一般的に硫黄は、その大きさから分極しやすく、孤立電子対にアクセスしやすいことから、非常に求核性が高いと言われています。
窒素の求核剤
窒素の求核剤には、アンモニア、アジド、アミン、亜硝酸塩などがあります。
関連ページ
- 親電子
- ルイス・ベース
質問と回答
Q: 求核剤とは何ですか?
A: 好中性とは、反応において化学結合を形成するために電子対を親電子に提供する種のことです。
Q: どのような分子やイオンが求核剤になり得るのでしょうか?
A: 自由電子対を持つすべての分子またはイオンが求核剤となり得ます。
Q: 求核剤が供与する一対の電子は何と呼ばれていますか?
A: ローンペアと呼ばれる電子のペアです。
Q: 求核剤はどのようなカテゴリーに分類されますか?
A: 求核剤は電子を与えるので、ルイス塩基に分類されます。
Q: 「求核剤」という用語は何を表しているのですか?
A: 「求核性」という用語は、求核剤が核に引き寄せられることを表しています。
Q: 「求核性」という用語は何を指しているのですか?
A: 「求核性」という用語は、物質の求核性を意味し、原子の引力を比較するためによく使われます。
Q: 「ソルボリシス」反応とは何ですか?
A: アルコールや水などの溶媒を用いた中性求核反応を「ソルボリシス」と呼びます。
百科事典を検索する