遷移状態とは?化学反応の活性化エネルギー・性質と中間体の違い
遷移状態とは何かを図解でわかりやすく解説。活性化エネルギー、性質、フェムト秒の短寿命と中間体との違い、化学反応の反応機構への影響を紹介。
化学反応において、エネルギーが最大となる点が遷移状態です。遷移状態を越えるのに必要なエネルギー差が活性化エネルギー(通常はエネルギーまたは自由エネルギーの差)で、反応速度を支配します。反応座標上では、反応物から生成物へ向かう途中の山の頂上に相当し、図示するとエネルギー対反応座標のグラフで局所的な最大値になります。グラフや文献では遷移状態をダブルダガーの記号‡で表すことが多いです。
遷移状態の性質(ポイントまとめ)
- 一級鞍点(saddle point):ポテンシャルエネルギー面(PES)上の一級鞍点に対応し、全ての方向において最小ではなく、反応座標方向に一つだけ最大(負の曲率)を持ちます。
- 虚数振動数:量子化学計算で遷移状態を確認する際は、振動解析でちょうど一つの虚数振動数(負の固有値)が存在することが目印です。その振動方向が反応物と生成物を結ぶ変形を表します。
- 短い寿命:エネルギーが高いため分子がその状態に留まる時間は極めて短く、典型的にはフェムト秒(10^-15 s)スケールです。
- 不可分離:遷移状態は平衡状態で存在する安定種ではないため、単離・分離はできません。ただし、遷移状態を模した構造(遷移状態アナログ)を設計して強く結合させることは可能です(酵素阻害剤の設計など)。
遷移状態と中間体の違い
中間体はポテンシャルエネルギー面上の局所的な最小点であり、ある程度の寿命を持ち得ます。中間体は単離または検出できることが多く(ラジカル、中性分子、イオンなど)、反応物と生成物の間に「谷」として存在します。これに対して遷移状態は「山の頂上」に当たり、寿命は非常に短く、振動解析で特徴づけられる点が決定的な違いです。
反応速度論と遷移状態理論
遷移状態を扱う理論の代表が遷移状態理論(Transition State Theory, TST)で、反応速度は遷移状態における定常的な集団とその通過頻度に依存すると考えます。実際の速度式としてはアレニウス則(活性化エネルギーEaを用いる)やアイリング(Eyring)方程式(ΔG‡:活性化自由エネルギーを用いる)が使われます。活性化エネルギー(Ea)と活性化自由エネルギー(ΔG‡)は関連しますが、温度依存性やエントロピー効果を含むかどうかで扱いが異なります。
実験的・計算的な研究手法
- 計算化学:量子化学(HF、DFT、波動関数法など)を用いて遷移状態の構造を最適化し、振動解析で一つの虚数振動数を確認します。最適化後に内在反応座標(IRC: Intrinsic Reaction Coordinate)を追跡して、その遷移状態が目的の反応物と生成物を結んでいるか確かめます。
- 超高速分光:ポンピングとプロービングを組み合わせたフェムト秒分光などで、反応中の短寿命種や遷移状態に近い動的挙動を間接的に観測する試みが行われています。
- 速度論的手法:温度依存性測定、同位体効果(キネティックアイソトープ効果)や線形自由エネルギー相関(Hammettプロットなど)により遷移状態の性質(荷電の分布、結合の進行度)を推定できます。
概念的法則と応用
- ハモンドの仮説(Hammond's postulate):可逆的に、遷移状態の構造は反応が吸熱か発熱かに応じて反応物側または生成物側に類似すると考えられます。すなわち、発熱反応では遷移状態は反応物に似ており、吸熱反応では生成物に似る傾向があります。
- 触媒の作用:触媒は遷移状態を安定化(あるいは別経路の低い遷移状態を提供)することで活性化エネルギーを下げ、反応速度を向上させます。酵素はまさに遷移状態を特異的に安定化することで巨大な速度向上を示します。
具体例
- SN2反応:求核置換(SN2)では、遷移状態は求核剤と離脱基が同時に部分的に結合した五配位に近い構造であり、反転を伴う単一の遷移状態を経て生成物が得られます。SN2では中間体は存在しません(単段階)。
- SN1反応:SN1では、まず離脱によってカルボカチオンの中間体が生成し、その後求核剤が付加するという二段階過程です。中間体が存在することがSN1の特徴です。
- 脱離反応(E2 vs E1):E2は一段階で遷移状態を経る共役的な脱離、E1は中間体(カルボカチオン)を経る二段階機構です。
まとめ
遷移状態は化学反応の鍵となる概念で、反応速度や選択性を支配します。中間体と混同してはいけません:中間体は存在可能な安定(あるいは半安定)な種であるのに対し、遷移状態は短時間しか存在しない鞍点です。今日では計算化学や超高速分光、速度論的解析を組み合わせることで遷移状態の理解が深まり、触媒設計や酵素機構の解明、反応経路の制御に応用されています。
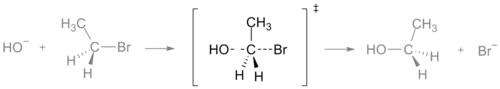
SN2反応の遷移状態
質問と回答
Q: 化学反応における遷移状態とは何ですか?
A: 遷移状態とは、化学反応においてエネルギーが最大になる点のことです。
Q: 化学反応における活性化エネルギーとは何ですか?
A: 反応が起こるために必要なエネルギーを活性化エネルギーといいます。
Q: 化学反応で2つ以上の分子が混ざるとどうなりますか?
A: 2つ以上の分子が混ざると、互いにぶつかります。遷移状態を通過するのに十分なエネルギーでぶつかると、反応して新しい分子ができます。
Q: 二重短剣(‡)記号は、化学反応のグラフや図面で何に使われますか?
A: 二重短剣(‡)記号は、化学反応のグラフや図面で遷移状態を示すのに使われます。
Q: なぜ化学反応の遷移状態を調べるのは難しいのですか?
A: 化学反応における遷移状態を調べるのは非常に困難です。なぜなら、遷移状態はエネルギーが非常に高く、分子がその状態にとどまる時間が非常に短いからです。
Q: 化学反応における中間体とは何ですか?
A: 中間体とは、化学反応におけるエネルギーの最小点に存在し、非常に長い時間生き続けることができる分子のことです。
Q: なぜ遷移状態の研究が反応機構を理解する上で重要なのですか?
A: 遷移状態を研究することは、反応がどのように起こるか、それをどのように制御または操作するかを決定するのに役立つので、反応機構を理解する上で重要です。
百科事典を検索する