化学反応機構とは|中間体・遷移状態・電子移動をやさしく解説
化学反応機構を図解でやさしく解説。中間体・遷移状態・電子移動の仕組みをステップで理解し、反応予測や設計に役立つ入門ガイド。
反応メカニズムとは、化学反応がどのような順序で、どのような段階を経て進行するかを詳しく記述したものです。実験で観察できるのは通常、反応前後の「全体の変化」だけで、途中で短時間だけ存在する種は直接見えないことが多いです。こうした一時的に存在する種が中間体で、ある中間体から次の中間体へ移る際には遷移状態(エネルギーの山)を通過します。反応全体を正しく理解するためには、各ステップ(何ができて何が壊れるか、電子がどこへ移動するか)を順に追って考えることが重要です。これにより、反応の速度や選択性を予測したり、望む生成物を得るための条件を設計したりできます。
基本的な概念
- 中間体:反応経路上で比較的安定に存在する一時的な化学種。例:カルボカチオン、カルバニオン、ラジカル、カルベン、イリドなど。
- 遷移状態:反応座標上の最高エネルギー点。寿命は極めて短く直接捕捉するのは難しいが、計算化学や間接的な実験から性質を推定できる。
- 反応座標図(エネルギー図):反応物と生成物のエネルギー差および活性化エネルギー(遷移状態までの高さ)を示し、反応の速さや可逆性、熱力学的安定性を理解するのに役立つ。
電子の移動と矢印表示
有機化学では、反応中にどのように電子が動くかを「曲線矢印(curved arrows)」で表します。矢印は常に電子対の動きを示す(単一の電子の場合は片矢印を用いる)ため、
- 矢印の出発点は電子の供給源(孤立電子対や既存の結合)
- 矢印の終点は電子が向かう場所(正電または空の軌道、π結合など)
これにより、どの結合が形成され、どの結合が切れるかが視覚的にわかりやすくなります。矢印のルールを守ることは、機構を正しく描くための基本です。
代表的な反応機構(有機化学の例)
特に有機化学でよく扱われる機構をいくつか挙げます。
- 求核性置換(SN2):求核剤が基質の反対側から直接攻撃して遷移状態を経て置換が一段階で起きる。立体化学的には反転が生じる。
- 求核性置換(SN1):脱離してまずカルボカチオンのような中間体ができ、その後に求核剤が結合する二段階反応。立体化学はしばしばラセミ化する。
- 脱離反応(E1・E2):E2は求核(塩基)と脱離基が同時に働く一段階の脱離、E1はまず脱離によって中間体ができ、その後プロトンが引き抜かれてアルケンが生成する二段階。
- 付加反応:π結合への求電子剤・求核剤の付加。立体選択や求電子剤の性質で反応様式が変わる。
- ラジカル反応:単一電子の移動が関与する連鎖反応(例:ハロゲン化の連鎖反応)。開始・伝播・終結のステップからなる。
これらの機構を理解すると、反応条件(溶媒、温度、塩基/求核剤の強さなど)をどう変えれば望む生成物が得られるかの見当がつきます。
遷移状態とホウムズの公理(Hammondの仮説)
遷移状態の構造は反応の熱力学に依存します。一般に、反応が遷移状態に近い生成物が安定なら遷移状態は生成物に似ていて(遷移状態が“後期”)、逆に反応物寄りなら“前期”です。これは反応の選択性や速度を考える上で有用なヒントになります。
触媒・溶媒・温度の影響
- 触媒:酸・塩基・金属錯体などは別の低エネルギー経路を作り、活性化エネルギーを下げることで反応を加速する。
- 溶媒:極性溶媒はイオン性中間体(カルボカチオンやカルバニオン)を安定化させ、反応経路を変えることがある。
- 温度:高温はエネルギー障壁を越えやすくするが、望ましくない副反応も起きやすくなる。
機構を調べる方法(実験と計算)
- 速度論(反応次数や速度定数の測定)から反応ステップ数や律速段階を推定する。
- 立体化学的証拠(光学活性の変化、配位の保持・反転)で一段階か二段階かを区別する。
- 同位体標識(位置や職位に重水素や同位体を入れる)で原子移動経路を追跡する。
- 中間体の検出:低温での捕捉、スペクトル(NMR, IR, MS, EPR)や速い時間分解測定で直接/間接に観察する。
- 計算化学(DFTなど)で遷移状態や中間体の構造・エネルギーを推定し、実験結果と照合する。
注意点・実務的なコツ
- 曲線矢印は「電子の流れ」を表すモデルであり、必ずしも電子が実際に矢印のように動くわけではない。モデルとしての有用性と限界を理解すること。
- 複数の経路が競合することが多く、最も低エネルギーの経路が支配的になる(ただし温度や触媒で変わる)。
- 機構の提案は仮説であり、実験的証拠で裏付けることが重要。合成設計や触媒開発には根拠のある機構理解が不可欠。
まとめると、反応機構は化学反応を深く理解し、制御するための「地図」です。中間体や遷移状態、電子移動のルールを学び、実験・計算で検証することで、より効率的で選択的な化学変換を設計できます。
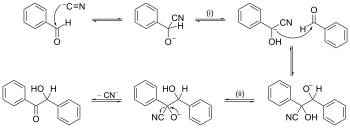
矢印を押した反応メカニズムの一例
質問と回答
Q: 反応機構とは何ですか?
A: 反応機構とは、化学反応がどのように作用するかを段階的に説明したものです。
Q: なぜ反応機構のすべてのステップを理解することが重要なのですか?
A: 難解な反応を理解したり、ある特定の方法で反応を起こそうとするためには、反応メカニズムのすべてのステップを理解することが重要です。
Q: 化学反応における中間体とは何ですか?
A: 中間体とは、化学反応において、反応が早すぎて見えない間に作られるもののことです。
Q: 化学反応における遷移状態とは何ですか?
A: 化学反応において、ある中間体から別の中間体へ移行する際に交差する状態のことです。
Q: 有機化学でよく使われる反応機構にはどのようなものがありますか?
A: 有機化学の反応機構は、求核置換、脱離、付加が一般的です。
Q: 化学反応機構におけるアロープッシュとは何ですか?
A: 矢印押しは、反応中の電子の移動の様子を描くのに使われることがあります。これにより、反応の過程でどの結合が形成され、どの結合が切断されるかを容易に確認することができます。
Q: 反応機構を理解することで、どのような情報を得ることができますか?
A: 反応機構を理解することは、反応を思い通りにする方法や、より難しい反応を理解するための情報を得ることができます。
百科事典を検索する