付加反応とは — 有機化学の定義・機構と代表例(求核・親電子)
付加反応の基礎と機構を図解でわかりやすく解説。求核・親電子の代表例や反応ステップを初心者から実践者まで網羅。
有機化学における「付加反応」は、複数の分子が結びついてより飽和度の高い(または結合が増えた)分子を生成する反応の総称で、典型的には分子の一方がすでに持っている二重結合や三重結合に対して起こります。付加は、炭素-炭素二重結合や、炭素-酸素、炭素-窒素といった不飽和結合に起こりやすく、生成物ではπ結合が切れて新たなσ結合が生じます。反応に関わる2つの分子の役割としては、電子を供給する側を求核剤と呼び、電子を受け取る側を親電子と呼びます。求核剤は新しい結合を作るために電子を与え、親電子はそれを受け取ります。付加反応は多くの場合脱離反応の逆過程(可逆)として理解できます。代表例には、アルケンへの水の付加や、カルボニルへの求核攻撃があります。
機構の分類(概略)
- 求電子付加(Electrophilic addition):π結合が求電子剤により活性化され、まず求電子剤がπ結合に付加して正電荷を持つ中間体(カルボカチオンや環状ハロニウムなど)が生じ、その後求核剤が中間体を攻撃して付加生成物ができる。ハロゲン化、ハロゲン化水素の付加、酸触媒下の水和などが典型例。
- 求核付加(Nucleophilic addition):電気的に求核性の高い試薬が電子求引性のπ受容体(例:カルボニルC=O)を直接攻撃する。カルボニルへの水素化(ヒドリド付加)、シアン化、グリニャール反応などが該当。
- ラジカル付加:ラジカル種が二重結合へ付加して新たなラジカルを作り、連鎖的に進行する。過酸化物などで開始される付加重合やハロゲンのラジカル付加が例。
- 共役(1,4)付加(Michael付加):α,β-不飽和カルボニルなどでは、求核剤がβ位に付加することで共役系を経由した1,4付加が起こる(1,2付加との競合がある)。
立体化学と選択性
- 立体化学(syn/anti):付加が同じ面から同時に起こるとsyn付加、反対面から順次起こるとanti付加となる。触媒的な水素化やヒドロボレーションでは主にsyn付加、臭素の付加はanti付加(環状ハロニウム中間体の開裂)を示すことが多い。
- 位置選択性(マルコフニコフ則):不対称アルケンへのHX付加では、一般に水素がより多くの水素を持つ炭素に付く(マルコフニコフ則)。ただし、ラジカル条件やヒドロボレーションなど反応条件を変えると反マルコフニコフ製品が優勢になることがある。
- 立体選択性:立体障害や触媒、溶媒により生成物の立体化学(エナンチオ選択、ジアステレオ選択)が制御されることがある。キラル触媒を用いた不斉付加は重要な合成手法。
代表的な付加反応(例)
- アルケンへのハロゲン付加(Br2、Cl2)— 環状ハロニウムイオン中間体を経てanti付加。
- ハロゲン化水素の付加(HBr、HCl)— 求電子付加でカルボカチオン中間体を経る(マルコフニコフ傾向)。過酸化物存在下でラジカル機構により反マルコフニコフ則が働く場合あり。
- 水の付加(酸触媒水和、酸触媒下のアルコール付加)— プロトン化により求電子性が高まり、その後求核的に水やアルコールが付加。
- ヒドロボレーション-酸化(アルケン→アルコール)— 反マルコフニコフでsyn付加。酸化でアルコール化。
- 触媒的水素化(H2、Pd/Pt)— π結合に水素がsynに付加して飽和化。
- アルキンの付加—二段階で二置換アルケンを経て飽和化(部分的水素化でcis/trans制御可能)。
- カルボニルへの求核付加—グリニャール試薬(R-MgX)や有機リチウム、アルドール付加、シアン化によるシアノヒドリン形成、還元(NaBH4、LiAlH4)によるアルコール化など。
- 共役付加(Michael)—α,β-不飽和カルボニルへの1,4付加。合成上重要な炭素–炭素結合形成反応。
中間体と反応座標
付加反応の経路は中間体と遷移状態に依存します。求電子付加ではカルボカチオンや環状ハロニウムといった高エネルギー中間体が生成することが多く、それらの安定性(第三級は安定、共役安定化など)によって生成物の配向性や反応速度が決まります。求核付加では極性の強いπ受容体(カルボニル)が直接攻撃を受けるため、中間体はアルコキシドやアルコキサニオン状となることが多いです。金属触媒を介した付加では、吸着や金属-炭素中間体を経て反応が進むため、立体選択性が制御しやすくなります。
実用上の注意点
- 条件依存性:酸や塩基、溶媒、温度、触媒(金属触媒や有機触媒)により機構や選択性が大きく変わる。
- 副反応:過剰付加、重合、転位や再配列、脱離を伴う場合があるため制御が必要。
- 立体化学の制御:不斉触媒やキラル補助基を使えばエナンチオ選択的な付加が可能。
まとめ
付加反応は、不飽和結合を持つ基質に対して電子のやり取り(求核/親電子あるいはラジカル)によって新しい結合を形成する基本的かつ多様な反応群です。反応機構、立体・位置選択性、中間体の安定性、反応条件の選択が合成上の成果を決めるため、それぞれを理解して適切な条件を選ぶことが重要です。付加反応は有機合成における炭素骨格構築や官能基の導入に不可欠なツールです。
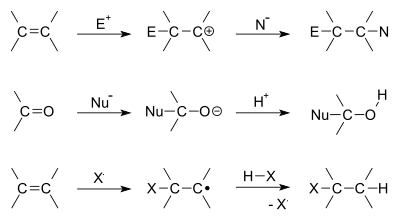
付加反応の例
質問と回答
Q: 有機化学における付加反応とは何ですか?
A: 付加反応とは、2つの分子が結合してより大きな分子を形成することで、分子の1つが二重結合または三重結合を持っている場合にのみ起こり得ます。
Q: 付加反応を起こすことができる結合にはどのようなものがありますか?
A: 炭素-炭素結合、炭素-酸素結合、炭素-窒素結合などが付加反応を起こす可能性があります。
Q: 付加反応における求核剤とは何ですか?
A: 求核剤とは、新しい結合を形成するために、他の分子に電子を提供する分子のことです。
Q: 付加反応における親電子体とは何ですか?
A:親電子とは、新しい結合を形成するために電子を受け入れる分子のことです。
Q: 付加反応は脱離反応とどう違うのですか?
A: 付加反応は2つの分子が結合してより大きな分子を形成し、消去反応はより大きな分子を2つの小さな分子に分解する。
Q: 付加反応の例を教えてください。
A: 二重結合への水の付加やカルボニルへの求核攻撃は、付加反応の一般的な例です。
Q: 二重結合や三重結合がなくても、付加反応は起こるのですか?
A: いいえ、付加反応には、関係する分子の少なくとも1つに二重結合または三重結合が必要です。
百科事典を検索する