スルホンとは?構造・合成法・化学反応と用途をわかりやすく解説
スルホンの基礎から構造、代表的合成法、主要な化学反応と産業用途まで図解と実例でわかりやすく解説する入門&実務ガイド。
スルホンは硫黄原子が2個の酸素原子と結合している分子です。硫黄は2つの酸素原子に2重結合しています。他の2つの基とは単結合です。通常、チオエーテルを酸化することによって作られる。
スルホンは多くの重要な化学反応に使用されています。例えば、ジュリアのオレフィン化反応では、アルデヒドからアルケンを作るのにスルホンを使用します。また、溶媒として使用されることもある。
構造と基本的性質
スルホン(一般式 R–SO2–R')は硫黄原子が酸素に2重結合を持ち、残る2つの結合で有機基とつながった化合物です。硫黄の酸化数は一般に+4で、中心の原子まわりは実質的に四面体に近い配位をとります。S=O結合は部分的に二重結合性をもち、極性が大きいためスルホン化合物は高い沸点・高い極性を示すことが多いです。
- 代表的例:ジメチルスルホン(メチルスルホニルメタン、MSM)、スルフォラン(テトラヒドロチオフェン1,1-ジオキシド)など。
- 物性:極性が高く、熱や酸・塩基に対して比較的安定。一部は溶媒や電解質、薬剤原料として利用される。
主な合成法
- チオエーテル(スルフィド)の酸化:最も一般的な方法で、過酸(m-CPBA)、過酸化水素(H2O2)、Oxone などの酸化剤を用いてスルフィド→スルホキシド→スルホンへ段階的に酸化します(元の段落の内容)。
- スルホニル塩化物からの導入:R–SO2Cl(スルホニルクロリド)を求核剤と反応させてスルホン誘導体を作る経路もあります。
- 直接的な合成法:工業的には二硫化物やチオールを出発物質として複合的に処理し、酸化・置換反応でスルホン骨格を構築することがあります。
代表的な化学反応と反応性
- α-水素の酸性化とアルキル化:スルホンに隣接する炭素(α位)は電子吸引性のため酸性が高く、塩基で脱プロトン化して安定なカルバニオンを与え、アルキル化や付加反応に利用されます。これがジュリアのオレフィン化反応などになくてはならない性質です。
- ジュリア(Julia)反応/Julia–Kocienski反応:スルホンを用いてアルデヒドやケトンと結合し、最終的にアルケンを生成する重要なC=C形成反応です(元の段落の内容)。
- ラムバーグ–ベックランド(Ramberg–Bäcklund)反応:ハロゲン化や脱酸素化を経てスルホンからアルケンを得る反応で、スルホンの脱硫プロセスを利用します。
- 脱スルホン化(還元):スルホン基の除去は還元条件下で可能で、有機合成の保護基的な使い方や変換に用いられます。
- 安定性:スルホンは酸化的に安定で、酸や塩基・高温に対して耐性があるため、多くの合成ステップを通過できることが利点です。
用途(産業・薬学・材料)
- 有機合成中間体:ジュリアオレフィン化など、C–C結合形成に不可欠な試薬として広く使われます。
- 溶媒:高極性溶媒の代表例であるスルフォランは、ガス精製や抽出、電解質溶媒などに産業的用途があります(元の段落の「溶媒として」の記述に該当)。
- 医薬品・農薬:スルホン骨格を持つ薬剤(例:ジアミノジフェニルスルフォン=ダプソンなど)があり、親水性や代謝安定性を与えるための設計単位として重要です。
- 高性能材料・ポリマー:耐熱性や耐薬品性を向上させるためのモノマーや末端基として使用されます。
- 食品・サプリメント:MSM(メチルスルホニルメタン)はサプリメントとして市販されることがあります(安全性は化合物ごとに異なります)。
安全性と取り扱いの注意
- 多くのスルホンは比較的安定で毒性は低めのものが多いですが、化合物ごとに毒性やアレルギー性が異なります。例えばダプソンは溶血性貧血などの副作用が知られています。
- 酸化剤や還元剤との反応、強酸・強塩基条件では副反応が起きることがあるため、取り扱い時は通常の有機化学実験の安全対策(換気、保護具、廃棄)を守ってください。
まとめ(ポイント)
- スルホンはR–SO2–R'という構造を持ち、極性が高く安定な化合物群。
- 主な合成法はチオエーテルの酸化で、酸化剤によりスルホキシドを経てスルホンへ。
- ジュリア反応やRamberg–Bäcklund反応など、有機合成で重要な反応に広く用いられる。
- 溶媒(例:スルフォラン)、医薬品、材料など産業的にも重要な用途がある。
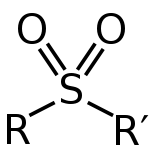
スルホンの構造。
百科事典を検索する