誘導進化(Directed Evolution)とは — 酵素・タンパク質改良の定義と手法
誘導進化(Directed Evolution)の定義、工業・医療分野での酵素・タンパク質改良手法(インビボ/インビトロ)と実装例をわかりやすく解説。
Directed evolution (DE)は、工業用または医療用の酵素を生産するために使用される方法です。単純化すると、「変異を導入して良いものを選ぶ」を高速に繰り返すことで、自然選択を人工的に短時間・特定目的で行う技術です。
基本概念
DEの核心は、目的の機能(例:基質特異性、安定性、活性、温度耐性、溶媒耐性など)を持つ分子を見つけ出すことにあります。まず、ターゲットとなる遺伝子を多様化させて変異体ライブラリを作成し、次にその中から所望の特性を示す変異体を選択またはスクリーニングで分離します。選ばれたものは次ラウンドのテンプレートとなり、これを繰り返すことで性能を段階的に改良します。
多様化(変異導入)の手法
- エラー・プルーフPCR(error-prone PCR):ポリメラーゼの誤挿入率を上げ、ランダムに点変異を導入する。
- DNAシャッフリング(遺伝子組換え):複数の類似遺伝子を断片化・再結合して新しい配列を作る(組換えにより複合的な改善を得やすい)。
- 部位飽和変異導入(site-saturation mutagenesis):活性部位や予測された鍵残基を標的に全アミノ酸候補を網羅的に作る。
- カセット変異導入・挿入・欠失:特定領域の長さや配列を大きく変える。
- 合成ライブラリー:塩基配列を合成して構築することで、特定の設計思想に基づく高品質な多様性を与える。
選択(Selection)とスクリーニング(Screening)
DEでは「選択」と「スクリーニング」が重要です。選択は生存や増殖に直結する条件を用いることで、高スループットかつ自動的に良い変異体を濃縮できます。一方、スクリーニングは個々の候補について機能を直接測定する方法で、より多様な性質(活性、特異性、安定性)の評価が可能ですが、労力・時間がかかります。
よく用いられる表示・連結技術:
- ファージディスプレイ:タンパク質をウイルス表面に提示して結合能をスクリーニング。
- 酵母表面ディスプレイ:表面発現を利用してフローサイトメトリーで高精度選抜。
- リボソームディスプレイ/mRNAディスプレイ:タンパク質と遺伝子を非細胞系で保持しつつ結合能を評価できる高多様性手法。
- セルベースの生化学的アッセイ:代謝補完や耐性獲得に基づく選択。
インビボ(生細胞内)とインビトロ(細胞外)の比較
DEは、インビボ(細菌または酵母の生きた細胞内)で行うことも、インビトロ(溶液中の遊離またはマイクロドロップレット)で行うこともできます。それぞれに利点と制約があります。
インビボの利点:細胞環境での発現・折り畳み・翻訳後修飾などを反映した選択ができるため、実際の応用環境に近い特性を得やすい。例えば、細胞表面や細胞質で働くタンパク質についてはその環境下で直接スクリーニングできる。
元の手順に従えば、生体内での進化の間、各細胞(通常は細菌や酵母)は、バリアントライブラリーの異なるメンバーを含むプラスミドで形質転換されます。興味のある遺伝子だけが細胞間で異なり、他のすべての遺伝子は同じに保たれます。
インビトロの利点:DEは、インビトロ転写翻訳を使用して、溶液中または人工微小液滴内でタンパク質またはRNAを遊離させることができます。これにより温度や有機溶媒など多様な条件下で実験が可能になり、細胞に対して毒性のあるタンパク質も発現させられます。さらに、インビトロ進化ではライブラリDNAを細胞に挿入する必要がないため、非常に大規模なライブラリ(最大1015個程度)を扱うことができ、希少な有望変異体を見つけやすくなります。
実験の流れ(典型的なパイプライン)
- ターゲット遺伝子と評価法の設計(どの特性をどう測るかを定義)。
- 多様化(変異導入)によるライブラリー作成。
- 発現と選択/スクリーニングにより有望候補を収集。
- 得られた候補のシーケンス解析と機能評価。
- 優れた候補を用いて次ラウンドのテンプレートとし、収束するまで反復。
応用例と利点・限界
応用は広範囲に及びます。工業的酵素(洗剤、食品加工、バイオ燃料)、医薬品合成用の触媒、抗体や結合タンパク質の最適化、安定化した診断用酵素などが代表的です。自然界に存在しない活性や高い耐熱性、極性溶媒耐性を人工的に生み出せる点が大きな利点です。
ただし制約もあります。適切なスクリーニング・選択系が設計できない場合や、得られた変異の基礎的な構造・機構理解を伴わないと予期せぬトレードオフ(特異性低下、副次的効果など)が生じることがあります。また、進化の「探索空間」は巨大であり、実験設計(どの残基をターゲットにするか、ライブラリのサイズ、選択圧の与え方)が成功の鍵になります。
まとめ
誘導進化は、自然選択の原理を模倣してタンパク質やRNAを目的に合わせて改良する強力な手法です。変異導入、適切な選択・スクリーニング法、反復的な最適化を組み合わせることで、従来の設計的アプローチでは達成しにくい機能獲得が可能になります。実験目的に応じて、インビボとインビトロの利点を使い分けることが重要です。
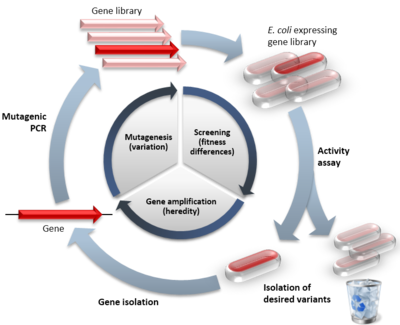
自然進化と比較した有向進化の例。内側のサイクルは有向進化サイクルの3つの段階を示し、括弧内は模倣された自然過程を示している。外側の円は典型的な実験のステップを示している。赤色の記号は機能的な変異体を示し、淡い記号は機能が低下した変異体を示す。
遺伝性の確保
機能性タンパク質が単離されると、その遺伝子も単離されている必要があるため、遺伝子型とフェノタイプのリンクが必要となります。
これは、mRNA遺伝子がプロマイシンによって翻訳の最後にタンパク質に連結されている共有結合的なものであってもよい。
あるいは、タンパク質とその遺伝子を一緒に、あるいはエマルジョン液滴中に保持することもできる。単離された遺伝子配列は、次いで、PCRまたは形質転換された宿主細菌によって増殖される。単一の最良の配列、または配列のプールは、次のラウンドの突然変異誘発のためのテンプレートとして使用することができます。多様化-選択-増幅のサイクルが繰り返されることにより、酵素のバリエーションが選択プロセスに適応したものとなる。

発現されたタンパク質は、その遺伝子(mRNAのように)と共有結合することができます(左)、またはそれと同じコンパートメントに置くことができます(右)。 いずれにしても、タンパク質をコードする遺伝子は単離されます。
受賞
質問と回答
Q: ディレクティッド・エボリューションとは何ですか?
A: 有向進化(DE)とは、産業用・医療用酵素の生産に用いられる手法です。自然淘汰を模倣したタンパク質工学の一種です。
Q: 有向進化はどのように行われるのですか?
A: 有向進化は、遺伝子を繰り返し変異させ、変異体のライブラリーを作ることによって行われます。そして、淘汰の結果、目的の機能を持つ遺伝子が分離され、それが次のラウンドのテンプレートとして使われる。
Q:有向進化はどこでできるのですか?
A:定向進化は、in vivo(バクテリア、酵母などの生きた細胞内)、in vitro(溶液やマイクロドロップレット中の自由な状態)で行うことができる。
Q:定向進化をin vivoで行うメリットは何ですか?
A:生体内で定向進化を行うことで、細胞内での性質を選択できるという利点があり、進化したタンパク質やRNAを生体内で利用する場合に有効である。
Q: 試験管内で有向進化させる利点は何ですか?
A: 試験管内で定向進化を行うと、温度や溶媒などの条件を多く設定でき、細胞にとって毒性のあるタンパク質も発現させることができるという利点があります。さらに、DNAを細胞に挿入する必要がないため、はるかに大きなライブラリーを作成することができます。
Q: In vitroの実験で何が制限されるのですか?
A: In vitroの実験でできることの大きさの限界は、多くの場合、どれだけのDNAを細胞に挿入する必要があるかによって決まります。
百科事典を検索する