タンパク質の定義と構造:アミノ酸配列・折りたたみ・機能の基礎
タンパク質の定義と構造を初心者向けに解説。アミノ酸配列・折りたたみ・化学修飾がもたらす安定性と機能の基礎を図解でわかりやすく紹介。
タンパク質は、アミノ酸という小さな単位からなる長鎖の分子である。これらのアミノ酸は互いにペプチド結合で連結され、一本の鎖(ポリペプチド)を形成することが基本形である。化学的性質や配列の違いにより、ポリペプチドは特定の立体構造をとり、その立体構造がタンパク質の機能を決定する。
1つまたは複数のポリペプチドが円形または繊維状に折り畳まれた生化学的な化合物である。ポリペプチド鎖がどのように折りたたまれるかは、鎖中のアミノ酸の性質(疎水性・親水性、電荷、分岐など)や、鎖間・鎖内で形成される水素結合、イオン結合、疎水相互作用、ジスルフィド結合などの化学的相互作用によって決まる。
構造の階層
- 一次構造:ポリペプチドを構成するアミノ酸の直線配列。配列は遺伝情報に由来する(下記)。
- 二次構造:αヘリックスやβシートなど、局所的に安定した規則的な折りたたみ。
- 三次構造:ポリペプチド全体がとる立体構造。複数の二次構造要素の相互配置として記述される。
- 四次構造:複数のポリペプチド鎖(サブユニット)が集合してできる複合体(例:ヘモグロビンは複数サブユニットから成る)。
アミノ酸配列と遺伝情報
ポリペプチドとは、アミノ酸の一本鎖のポリマーである。ポリペプチドを構成するアミノ酸の配列は、遺伝子のDNA配列に由来する。遺伝情報は転写・翻訳の過程を経てタンパク質配列へと変換され、遺伝暗号によって20種類の標準アミノ酸が指定される。さらに翻訳後に起こる化学的な修飾(リン酸化、糖鎖付加、メチル化、アセチル化など)はタンパク質の折りたたみ、安定性、局在、活性、および機能を大きく変化させる。
立体構造の安定化要因と折りたたみ過程
タンパク質の立体構造は、次のような相互作用で安定化される:
- 水素結合(主鎖・側鎖間)
- 疎水相互作用(疎水性残基の集合)
- イオン結合(塩橋)や静電相互作用
- ジスルフィド結合(システイン残基間の共有結合)
- 金属イオンや補因子との配位結合
タンパク質はしばしば翻訳と同時か翻訳直後に正しい立体構造へ折りたたまれるが、複雑な折りたたみにはシャペロン(分子シャペロン)と呼ばれる補助因子が必要になることがある。誤って折り畳まれたタンパク質は凝集を起こし、細胞障害や変性疾患(例:アルツハイマー病やプリオン病)を引き起こすことがある。
補助因子と翻訳後修飾
合成直後に、いくつかのアミノ酸は化学的に修飾される。これにより、タンパク質の折りたたみ、安定性、活性、および機能が変化する。タンパク質には、補酵素として、ペプチド以外の基(ビタミン由来の補因子や金属イオン)が付いていることがあります。これらの補因子は触媒活性や電子移動、基質結合に必須であることが多い。
生物学的機能
細胞内外でのタンパク質の役割は非常に多岐にわたる。主な機能を挙げると:
- 酵素:化学反応の触媒として働く
- 構造タンパク質:細胞骨格や組織の構造を保持する(例:コラーゲン、アクチン)
- 輸送・貯蔵:酸素運搬(ヘモグロビン)、イオンや分子の輸送(例:チャネル、トランスポーター)
- シグナル伝達:受容体やホルモン、二次メッセンジャーの制御に関与
- 免疫応答:抗体や補体系の構成要素として病原体を認識・中和
- 運動:モータータンパク質(例:ミオシン、キネシン)による力の発生と輸送
ほかにも翻訳因子や転写因子、細胞周期制御因子など、ほぼすべての細胞プロセスにタンパク質が関与している。これは、他の生体高分子(多糖類や核酸)と同様に、タンパク質が細胞の機能的基盤を成しているためである。
研究法と応用
タンパク質の構造や機能を調べる代表的な方法には次がある:X線結晶構造解析、核磁気共鳴(NMR)、クライオ電子顕微鏡(cryo-EM)、質量分析など。バイオインフォマティクスを用いた配列解析や構造予測(例:αFoldなどの計算法)も急速に発展している。これらは創薬、酵素設計、バイオテクノロジー分野で重要な役割を果たす。
まとめ
タンパク質は、アミノ酸の配列に基づいて折りたたまれ、多様な立体構造と機能を持つ生体分子である。遺伝子情報から合成され、翻訳後の修飾や補因子により機能が多様化する。正しい折りたたみとその調節は生命活動にとって不可欠であり、その理解は医学・バイオテクノロジーにおける応用に直結する。
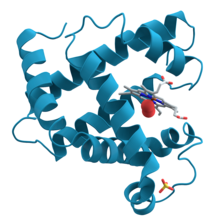
ターコイズ色のαヘリックスを持つミオグロビンの3D図。このタンパク質は、世界で初めてX線結晶学によってその構造が解明された。コイルの右中央には、酸素分子(赤)が結合したヘム基(灰色)がある。
人体用タンパク質
タンパク質は、その形状によって機能が異なります。肉や筋肉に多く含まれています。成長や修復、骨の強化などに使われます。組織や細胞を作るのに役立ちます。動物、植物、菌類、バクテリア、そして人間の体にも含まれています。
筋肉には多くのタンパク質が含まれています。タンパク質が消化されると、アミノ酸に分解されます。これらのアミノ酸は、新しいタンパク質を作るために使用することができます。タンパク質は、牛乳、卵、肉、魚、豆、ほうれん草、ナッツなどの食品に重要な役割を果たしています。タンパク質の働きを決める要素は4つあります。1つ目は、アミノ酸の順番です。アミノ酸の種類は20種類あります。2つ目は、鎖のちょっとしたねじれ。3つ目は、全体の構造がどのように折りたたまれているか。4つ目は、異なるサブユニットで構成されているかどうかです。例えば、ヘモグロビン分子は4つのサブユニットで構成されています。
ダメージを与える突然変異
ほとんどのタンパク質は酵素であり、突然変異によってその働きが低下したり停止したりすることがあります。ヒトのがんの50%は、腫瘍抑制因子であるp53の変異によって引き起こされます。p53は細胞分裂を制御するタンパク質です。
必須アミノ酸
動物は必要なアミノ酸をすべて作ることはできない(ほとんどは作ることができる)ので、タンパク質は動物の食生活に必要なものである。ある種のアミノ酸は食物から摂取しなければならない。これを「必須アミノ酸」と呼ぶ。動物は摂取したタンパク質を消化して遊離アミノ酸に分解する。アミノ酸は代謝の過程で体に必要な酵素や構造物を作るのに使われます。
人間には9種類の必須アミノ酸があり、食物から摂取します。必須アミノ酸は、ヒスチジン、イソロイシン、ロイシン、リジン、メチオニン、フェニルアラニン、スレオニン、トリプトファン、バリンの9種類です。人間が必要とする必須アミノ酸は、肉にはすべて含まれているが、植物にはほとんど含まれていない。しかし、小麦とピーナッツバター、米と豆など、植物を混ぜて食べれば、必要な必須アミノ酸をすべて摂取することができます。豆腐などの大豆製品やキヌアにも必須アミノ酸が含まれていますが、これらだけでは人間に必要なタンパク質を摂取することはできません。
ベルゼリウス(Jöns Jacob Berzelius)という科学者がタンパク質の名前をつけましたが、他にも多くの科学者がタンパク質を研究しています。

卵白には多くのタンパク質が含まれている
関連ページ
質問と回答
Q: タンパク質とは何ですか?
A: タンパク質は、アミノ酸という小さな単位から作られる長鎖の分子です。
Q: アミノ酸はどのように結合するのですか?
A: アミノ酸は、ペプチド結合で結合しています。
Q: ポリペプチドとは何ですか?
A: ポリペプチドは、アミノ酸の一本の直鎖状高分子です。
Q: ポリペプチドのアミノ酸の配列はどこから来ているのですか?
A: ポリペプチドのアミノ酸の配列は、遺伝子のDNA配列に由来しています。
Q: 合成直後、いくつかのアミノ酸はどうなるのでしょうか?
A: 合成後すぐに、いくつかのアミノ酸は化学的に修飾されます。
Q: タンパク質中のアミノ酸の修飾はどのようなことをするのですか?
A: タンパク質のアミノ酸の修飾は、タンパク質の折り畳み、安定性、活性、および機能を変化させます。
Q: すべてのタンパク質はアミノ酸だけからできているのですか?
A: いいえ、タンパク質には補酵素として、ペプチド以外の基が結合していることがあります。
百科事典を検索する