共役系とは?非局在化π電子の定義・性質・代表例(グラファイト・導電性ポリマー)
共役系とは何か?非局在化π電子の定義・性質を分かりやすく解説。グラファイトや導電性ポリマー等の代表例と応用も紹介。
化学における共役系とは、接続されたp軌道の系で、非局在化された電子を持つ領域を指します。一般には、単結合(σ結合)をはさんで交互に並ぶ単結合と多重結合(π結合)が連続することで生じます。共役が成立すると、個々のπ電子は特定の二原子の結びつきに局在するのではなく、複数の原子にまたがって非局在化し、分子全体のエネルギーを下げて安定化をもたらします。
基本的な性質
- 非局在化と共鳴:共役系では複数の共鳴構造が寄与し、電子密度が広く分散します。これにより安定性が増し、反応性や電気的性質が変化します。
- 分子軌道の広がり:隣接するp軌道が重なり合うことでπ系の分子軌道が広がり、HOMO(最高被占軌道)とLUMO(最低空軌道)のエネルギー差(バンドギャップ)が縮小します。これが光学吸収や導電性に直結します。
- 平面性と重なりの重要性:p軌道の有効な重なりには分子の平面性やねじれの小ささが重要です。ねじれると重なりが減り、共役効果が弱まります。
- 芳香族性(アロマティシティ):環状の共役系の中には、Hückel則に従うことで特に安定化する芳香族化合物(例:ベンゼン)があり、これも共役による一例です。
π電子の非局在化(電子の振る舞い)
共役系では、隣り合うp軌道が連続的に並び、π電子がその連続領域に広がります。π電子は個々の二原子結合に固定されるのではなく、分子の複数原子にまたがって存在するため、光吸収波長の赤方偏移(長波長側への吸収)や電荷輸送が可能になります。
代表的な例と用途
- 小分子の例:ベンゼン、1,3-ブタジエンなどの単純な共役系。これらは基礎的な反応性やスペクトルの教科書例です。
- 導電性ポリマー:ポリアセチレン、ポリチオフェン、ポリアニリンなどは長い共役鎖を持ち、ドーピングにより導電性を示します。これらは有機エレクトロニクスやセンサー、太陽電池材料に使われます。
- グラファイトとカーボンナノチューブ:グラファイトは広い二次元共役ネットワークを持ち、自由電子に近いキャリアを多数持つため熱的・電気的に優れた伝導性を示します。カーボンナノチューブは同じくπ系の延長であり、構造により金属性または半導体性を示します。
- 色素・染料・有機発光材料:共役長が長くなるほど光吸収は長波長側へ移動し、色の調節や発光波長の設計が可能です(有機EL、太陽電池の色素還元)。
その他の重要点
- 交差共役(クロス共役)と中断された共役:共役が必ずしも直線的に延びるとは限らず、ある位置で交差する場合(例:イソレン類)や不連続になる場合があり、それぞれ電子の局在化・反応性に影響します。
- ラジカルやイオン性の共役系:共役系は中性分子だけでなく、ラジカル、カルボカチオン、カーボアニオンなどの非対称電子配置でも安定化を与えます(例えばカルボカチオンの共鳴安定化)。
- ヘテロ原子とd軌道の寄与:酸素や窒素などのヘテロ原子はその孤立電子対で共役系に関与し、電子供与・引抜性を変えます。また、より大きな原子ではd軌道が共役に寄与する場合もあり、特に遷移金属複合体のπ共役に影響します。
- 物性の測定:共役系の存在や長さはUV-Vis吸収、NMRの共鳴シフト、X線回折や電気伝導測定などで評価されます。
まとめ(ポイント)
- 共役系は接続したp軌道の系で、π電子の非局在化により分子の安定性や特異な光学・電気特性を生む。
- 共役の長さや平面性、交差の有無、ヘテロ原子の存在などが性質を決める。
- グラファイト、導電性ポリマー、カーボンナノチューブなどは広い共役系をもち、材料応用(導電性材料、光電変換、色素など)で重要。

共役系フェノール化合物の一種であるシンナムアルデヒド
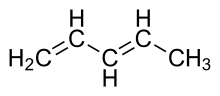
1,3-ペンタジエン
メカニズム
さまざまなタイプの分子構造が共役をもたらすことがあります。共役化のためには、鎖内のすべての隣接原子が利用可能なp軌道を持っていなければなりません。多くの場合、共役系は単結合の連続であり、それぞれが二重結合に続いています。他のシステムが存在する。例えば、フラン(図参照)は、2つの交互の二重結合と1の位置に酸素を持つ5員環です。フランの酸素は2つのローンペアを持っており、そのうちの1つはその位置のp軌道を満たしています。一対の電子は五員環上での共役を可能にします。リング中の窒素の存在は、共役に必要なπ軌道の供給源となります。また、共役に必要なπ軌道は、カルボニル基(C=O)、イミン基(C=N)、ビニル基(C=C)、アニオンなどのような環の置換基αに由来することもあります。
クロモフォア
共役系は発色団を構成する主なものです。発色団は分子の光吸収部分であり、化合物を目に見える色にすることができます。発色団は、様々な有機化合物に含まれていることが多く、また、暗闇で色がついたり、光ったりするポリマーに含まれていることもあります。発色団は、しばしば、一連の共役結合および/または環系からなり、これには、C-C、C=C、C=O、またはN=N結合が含まれ得る。多くの場合、発色団は芳香環を有する。
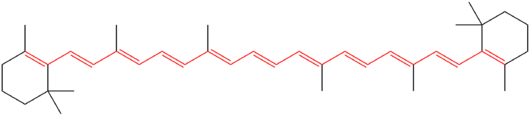
β-カロチンの化学構造。分子の発色団を形成する11個の共役二重結合が赤で強調されている。
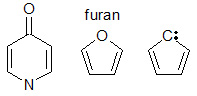
異なる種類のp軌道供与基との共役化
一般的な例
関連ページ
- 共鳴(化学
- 超共役
- クロス共役
- ポリエン
質問と回答
Q: 化学における共役系とは何ですか?
A: 共役系とは、非局在化した電子を持つp軌道が連続的かつ平行に並んだ系のことです。
Q: 共役系はどのように作られるのですか?
A: 共役系は、単結合で区切られたいくつかの多重結合によって作られます。
Q: 共役系にはどのようなものがあるのか?
A: 共役系には、ローンペア、ラジカル、カーボニウムイオンが含まれることがあります。
Q: 共役系を持つ化合物は、環状になることができますか?
A: はい、共役系化合物は、環状、非環状、直鎖状、混合状のいずれにもなりえます。
Q: 共役系を持つ分子にはどのような特徴があるのですか?
A: 共役系分子は、非局在化した電子を多くの原子で共有することにより、通常の化合物とは異なるユニークな性質を持っています。
Q: 共役系の重なりはどのようなものですか?
A: 共役とは、あるp軌道が、その間にあるシグマ結合(または単結合)を挟んで他のp軌道と重なり合うことを言います。
Q: 最大の共役系はどこにあるのか?
A: 最も大きな共役系(共有電子の数が最も多い)は、グラファイト、導電性高分子、カーボンナノチューブです。
百科事典を検索する