タンパク質フォールディング(折りたたみ)とは:仕組み・影響・関連疾患
タンパク質フォールディングの仕組み、誤折りたたみによる影響と関連疾患(アルツハイマー等)を図解でわかりやすく解説。
タンパク質のフォールディングは、タンパク質がその機能的な形状や「構造」を得るプロセスです。これは主に自己組織化のプロセスです。ランダムなコイルから出発して、ポリペプチドは、その特徴的な作業形状に折りたたまれます。構造は水素結合によって一緒に保持されています。
仕組み(分子レベル)
タンパク質の折りたたみは単純な直線的過程ではなく、複雑なエネルギー地形(folding energy landscape)をたどる動的なプロセスです。主に次のような相互作用が折りたたみを駆動します:
- 疎水相互作用:非極性側鎖が水から逃れようと内側へ集まることで一次的な折りたたみ駆動力になります。
- 水素結合:αヘリックスやβシートなどの二次構造を安定化します(原文で触れている水素結合)。
- イオン結合(塩橋)・静電相互作用:局所的な安定化や特異的な相互作用を与えます。
- ジスルフィド結合:システイン間の共有結合は、タンパク質の三次構造を強く固定します(特に分泌タンパク質で重要)。
- ファンデルワール相互作用:原子レベルでの密な充填が立体配座を決めます。
折りたたみはしばしば段階的に進み、中間体(molten globuleなど)を経て最終のネイティブ構造に到達します。生体内では多くのタンパク質が合成と同時に部分的に折りたたまれる(共翻訳的折りたたみ)か、シャペロンと呼ばれる分子の助けを借りて正しく折り畳まれます。
基本的な段階
- 各タンパク質は、mRNAの配列からアミノ酸の直鎖に翻訳されると、展開されていないポリペプチドまたはランダムコイルとして存在します。このポリペプチドは、発達した立体構造を一切持たない(上図左)。共翻訳的折りたたみやシャペロン介在の機構がここから始まります。
- アミノ酸は互いに相互作用して、タンパク質が折り畳まれた立体構造を作ります(図の右側)。これがネイティブ状態として知られています。得られた立体構造は、アミノ酸配列によって決定される(アンフィンセンのドグマ)。しかし、細胞内では翻訳速度やシャペロン、翻訳後修飾なども最終構造に影響を与えます。
細胞内での品質管理(プロテオスタシス)
細胞は折りたたみの誤りや蓄積を防ぐために複数の監視系を持ちます。代表的な仕組みは次の通りです:
- 分子シャペロン:Hsp70、Hsp90、トリコディオン/シャペロニン複合体(GroEL/GroESなど)が未折りたたみや部分折りたたみ状態を認識し、正しい折りたたみを促進します。
- ER関連分解経路(ERAD):分泌タンパク質や膜タンパク質で誤って折りたたまれたものは、小胞体から分解装置へ送られユビキチン化されてプロテアソームで分解されます。
- 小胞体ストレス応答(UPR):不良タンパク質が蓄積すると転写応答でシャペロンや分解因子が誘導されます。
- オートファジー:大規模な凝集体や損傷したオルガネラはオートファジーで除去されます。
正しい折りたたみと可変性
正しい立体構造がなければ、タンパク質は機能しません。しかし、タンパク質の一部が折りたたまれないことがあります:これは正常なことです。いわゆる本質的に無秩序なタンパク質(intrinsically disordered proteins, IDPs)は、はっきりした三次構造を持たずに機能する例が多数あります。これらは柔軟性を利用して複数の相互作用パートナーに対応したり、シグナル伝達で重要な役割を果たしたりします。
誤った折りたたみと健康への影響
タンパク質が本来の形に折りたたまれない場合、そのタンパク質は不活性であり、通常は毒性を持っています。病気は、タンパク質が誤った形で折りたたまれたことに起因すると考えられている例が多くあります。誤折りたたみは可溶性のオリゴマーや不溶性のフィブリル(アミロイド線維)を生じ、細胞機能を阻害したり、細胞死を誘導したりします。
代表的な疾患例:
- アルツハイマー病:アミロイドβおよびタウの凝集による神経変性。
- パーキンソン病:αシヌクレインの凝集(レビー小体)。
- ハンチントン病:ポリグルタミン伸長(polyQ)によるタンパク質凝集。
- プリオン病(クロイッツフェルト・ヤコブ病など):正常プリオンタンパク質(PrP)が異常立体構造に変換され、それが他のPrPを転換させる伝播性のある疾患。
- 嚢胞性線維症:CFTRタンパク質(ΔF508など)の誤折りたたみによる機能喪失。
- トランスサイレチン(TTR)アミロイドーシス:TTRの安定性低下によるフィブリル形成。
また、多くのアレルギーはタンパク質の立体構造や安定性と関連します。抗原性は立体構造に依存することが多く、免疫システムはすべての可能なタンパク質構造に対して抗体を生成することはできませんが、誤折りたたみにより新たなエピトープが露出して免疫反応を引き起こすことがあります。
研究手法と応用
タンパク質の折りたたみや構造を調べるための主要な手法:
- X線結晶構造解析、核磁気共鳴(NMR)、クライオ電子顕微鏡(cryo-EM)— 高分解能構造決定。
- 円二色性(CD)や蛍光分光、ストップフローを用いた折りたたみ動力学の測定。
- フォールディング経路解析(φ値解析など)や分子動力学シミュレーション。
- 最近では、機械学習を用いた構造予測(例:AlphaFoldなど)が実用的な予測精度を示し、構造生物学や医薬品設計に大きな影響を与えています。
臨床応用としては、誤折りたたみを抑える薬(ファーマコロジカルシャペロン)、凝集体を除去する免疫療法、プロテアソームやオートファジーを賦活化する戦略などが研究・開発されています。
まとめと注意点
タンパク質フォールディングは、一次配列から高度に特異的な三次元構造を獲得する過程であり、生命活動の基本です。同時に、折りたたみ不良は多くの疾患の原因となり得るため、折りたたみ機構の理解と細胞内品質管理の維持は医学・バイオテクノロジーにおける重要な研究分野です。最新の計測技術と計算手法の進歩により、折りたたみ過程の解明と治療法の開発が進んでいます。
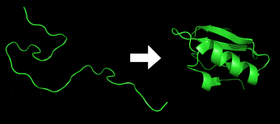
折り畳み前と折り畳み後のタンパク質
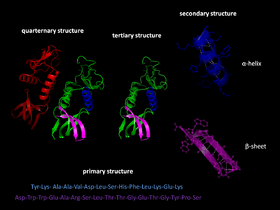
タンパク質のフォールディングは、タンパク質の構造を形成するための第三段階です。
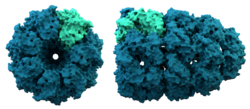
シャペロニンの構造。シャペロニンは、いくつかのタンパク質の折り畳みを助ける。
シャペロン
シャペロニンは、合成後のいくつかのタンパク質の折り畳みを助ける大きなタンパク質です。一般的にシャペロンは、ヒストンとDNAが結合してヌクレオソームを形成するのを助けることが最初に発見されました。ヌクレオソームは染色体を構成するブロックです。現在では、これが多くの細胞小器官の構築方法であることが明らかになっています。
質問と回答
Q:タンパク質の折り畳みとは何ですか?
A: タンパク質の折り畳みとは、ポリペプチド鎖が、アミノ酸からなる展開された直鎖状から、特徴的な立体形状に変化する過程のことです。
Q: 何が構造を支えているのですか?
A: 折り畳まれたタンパク質の構造は、水素結合によって保持されています。
Q: タンパク質の折り畳みにはどのような段階があるのですか?
A: タンパク質の折り畳みの段階は、mRNAからアミノ酸の直鎖に翻訳される際に、折り畳まれていないポリペプチドまたはランダムコイルが、互いに作用し合って、ネイティブな状態として知られる明確な三次元構造を作り出すことです。
Q: タンパク質が正しく折りたたまれないとどうなるのですか?
A: タンパク質が本来の形に折り畳まれないと、不活性で、通常は有毒です。これは、免疫系が認識できない誤った折り畳みタンパク質によって引き起こされる、いくつかの病気やアレルギーの原因となります。
Q: 2020年にタンパク質の折り畳み問題を解決したのは誰ですか?
A:2020年11月30日、人工知能企業DeepMindによって、タンパク質の折り畳みが解決されました。
Q:アンフィンセンのドグマとは何ですか?A:アンフィンセンのドグマとは、折り畳まれたタンパク質の結果としての立体構造は、そのアミノ酸配列によって決定されるというものです。
百科事典を検索する