アミノ酸とは?定義・20種類の働きと必須アミノ酸の解説
アミノ酸の基本から20種類の働き、必須アミノ酸の摂取法までわかりやすく解説。タンパク質生成や健康への影響を図解でチェック。
アミノ酸はタンパク質の構成要素です。真核生物では、20種類の標準アミノ酸があり、そのほとんどがあらゆるタンパク質を構成しています。
定義と化学構造
生化学では、アミノ酸とは、一般にアミン基(NH2)とカルボキシル基(COOH)の両方を一つの分子に持つ化合物を指します。生化学的には、もっと狭く一般式 H2NCHRCOOH をもつα-アミノ酸を指すことが多く、Rは各アミノ酸の側鎖(サイドチェーン)を表します(図を参照)。側鎖の性質が異なることで、アミノ酸ごとに極性、電荷、疎水性などの特徴が変わり、それがタンパク質の立体構造や機能を決めます。
種類と数
現在までに約500種類のアミノ酸が知られていますが、タンパク質を構成する「標準的な20種類のアミノ酸」が最も重要です。これらの20種は遺伝暗号によって指定され、翻訳の過程でmRNAからタンパク質へと組み込まれます。一方で、翻訳後に側鎖が化学修飾されることで多様な機能が付与され、非標準アミノ酸も生体内で重要な役割を担います。
20種類の分類(簡易)
- 疎水性(非極性): グリシン、アラニン、バリン、ロイシン、イソロイシン、フェニルアラニン、トリプトファン、プロリン、メチオニン
- 極性(電荷を帯びない): セリン、スレオニン、アスパラギン、グルタミン、チロシン、システイン
- 酸性(負に帯電): アスパラギン酸、グルタミン酸
- 塩基性(正に帯電): リシン、アルギニン、ヒスチジン
必須アミノ酸(ヒト)と条件付き必須
標準20種類のうち9種類は、大人の人間にとって「必須アミノ酸」とされています。必須とは、体内で十分に合成できないため食事から摂取する必要があるという意味です。代表的な必須アミノ酸は次のとおりです:
- イソロイシン
- ロイシン
- リシン
- メチオニン
- フェニルアラニン
- トレオニン
- トリプトファン
- バリン
- ヒスチジン(成人では必須性が議論されるが、乳児や成長期では必須)
さらに、アルギニンやシステインなどは通常は体内で合成できますが、成長期、外傷、病気などの状態では「条件付き必須アミノ酸」となり、食事由来の補給が必要になることがあります。必須アミノ酸の組成は種によって異なり、種によって必須とされるものが変わります。例えば、草食動物はそれぞれの食性に応じた必須アミノ酸パターンを持ちます。牛のような反芻動物は、第一・第二胃室にいる微生物により一部のアミノ酸を供給されます(微生物を介した合成)。
主な生理機能
- タンパク質合成: 最も基本的な役割はタンパク質の構成単位となることです。アミノ酸の配列(一次構造)が折りたたまれてさまざまな立体構造・機能を生み出します。すべてのタンパク質にはアミノ酸の配列があり、その配列によってタンパク質はさまざまな形になり、さまざまな機能を持っています。
- 酵素・ホルモンの前駆体: 多くの酵素やホルモンはアミノ酸から合成されます。例:チロシンから作られる甲状腺ホルモンやカテコールアミン(ドーパミン、ノルエピネフリン、エピネフリン)。
- 神経伝達物質の前駆体: トリプトファンはセロトニン、チロシンはドーパミンやノルアドレナリンの前駆体です。
- エネルギー源および代謝中間体: 必要に応じてアミノ酸は分解され、糖新生やクエン酸回路に供給されてエネルギー源になります。過剰窒素は尿素回路で尿素として排泄されます。
- 免疫・成長・修復: 抗体や筋肉、皮膚、臓器の修復と合成に不可欠です。
合成と分解の概要
非必須アミノ酸は体内で他の代謝物から合成されます(例:トランスアミネーション反応)。一方、アミノ酸の分解(脱アミノ反応や側鎖の酸化など)により生じた窒素は尿素回路で処理され、主に尿素として排出されます。これらの代謝パスは肝臓や筋肉で活発に行われます。
食事と栄養
アミノ酸は食事から摂取され、たんぱく質を消化することで遊離アミノ酸や小さいペプチドとして吸収されます。動物性食品(肉、魚、卵、乳製品)は一般に必須アミノ酸をバランスよく含む「良質たんぱく」とされますが、植物性食品でも豆類や穀類を組み合わせることで必須アミノ酸のバランスが補えます。サプリメントとしてアミノ酸を摂取する場合は、過剰摂取やバランスの偏り、薬剤との相互作用に注意が必要です(必要に応じて医療専門家へ相談してください)。
修飾アミノ酸と非標準アミノ酸
翻訳後修飾(リン酸化、メチル化、アセチル化、糖鎖付加など)により、タンパク質の機能や局在が制御されます。また、システインのジスルフィド結合やプロリンによる構造制限など、側鎖による特徴が立体構造に大きく影響します。さらに、セレノシステインやピロリシンのような「特殊なアミノ酸」は特定の生物で翻訳機構に組み込まれ、独自の機能を持ちます。
補足
前述のとおり、約500種類のアミノ酸が知られていますが、動物にとって最も重要なのは長い鎖として連なり機能を発揮するタンパク質を作る能力です。アミノ酸は、タンパク質のアルファベットのようなもので、数種の組み合わせで無数の「文章=機能」を作り出します。
参考や詳細を調べたい場合は、基礎生化学や栄養学の教科書、信頼できる医学・栄養のウェブサイトを参照してください。
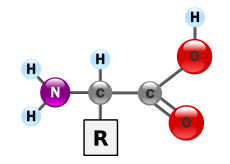
アミノ酸はタンパク質の最終生成物であり、左がアミノ基、右がカルボキシル基であるα-アミノ酸の一般的な構造。
構造
アミノ酸とは、有機化学物質の一つです。4つの基が共有結合したα-炭素原子で構成されています。
- 水素原子
- アミノ基
- カルボキシル基(-COOH
- 変数R群
すべてのアミノ酸は、プロリンを除き、少なくとも1つのアミノ基(-NH2)と1つのカルボキシル基(-COOH)を有する。
遺伝子発現と生化学
これらは、タンパク質の構成要素であるタンパク質原性アミノ酸です。これらのアミノ酸は、あらゆる生物の遺伝子コードにコード化された細胞機械によって生成されます。
| アミノ酸 | ショート | 省略 | コドン |
| 人間の本質的な2. |
| A | アラ | GCU, GCC, GCA, GCG | 7.8 | 否 | |
| C | シス | UGU、UGC | 1.9 | 条件付きで | |
| アスパラギン酸 | D | アスペ | GAU、GAC | 5.3 | 否 |
| グルタミン酸 | E | グルー | GAA、GAG | 6.3 | 条件付きで |
| フェニルアラニン | F | フェ | UUU、UUC | 3.9 | 噫 |
| グリシン | G | グライ | GGU、GGC、GGA、GGG | 7.2 | 条件付きで |
| ヒスチジン | H | 彼の | CAU、CAC | 2.3 | 噫 |
| イソロイシン | I | イル | AUU、AUC、AUA | 5.3 | 噫 |
| リジン | K | ライス | AAA、AAG | 5.9 | 噫 |
| ロイシン | L | レウ | UUA、UUG、CUU、CUC、CUA、CUG | 9.1 | 噫 |
| メチオニン | M | メット | オーグ | 2.3 | 噫 |
| アスパラギン | N | アンスン | AAU、AAC | 4.3 | 否 |
| ピロリジン | O | ピル | うわぐすり | 0 | 否 |
| プロリン | P | プロ | CCU、CCC、CCA、CCG | 5.2 | 否 |
| グルタミン | Q | グルン | CAA、CAG | 4.2 | 否 |
| アルギニン | R | アルゴ | CGU、CGC、CGA、CGG、AGA、AGG | 5.1 | 条件付きで |
| セリン | S | 卿 | UCU、UCC、UCA、UCG、AGU、AGC | 6.8 | 否 |
| スレオニン | T | スル | ACU、ACC、ACA、ACG | 5.9 | 噫 |
| セレノシステイン | U | セック | UGA** | >0 | 否 |
| バリン | V | ヴァル | GUU、GUC、GUA、GUG | 6.6 | 噫 |
| W | トランプ | アグ | 1.4 | 噫 | |
| Y | タイラー | UAU、UAC | 3.2 | 条件付きで | |
| コドンを止める | - | 項 | UAA, UAG, UGA†††. | - | - |
* UAGは通常、琥珀色の停止コドンですが、PYLIS要素が存在する場合はピロリジンをコードします。
** UGAは通常はオパール(またはアンバー)の停止コドンですが、SECIS要素が存在する場合はセレノシステインをコードします。
停止コドンはアミノ酸ではありませんが、完全性を確保するために含まれています。
UAG と UGA は常に停止コドンとして作用するわけではありません(上記参照)。
必須アミノ酸はヒトでは合成できません。必須アミノ酸はヒトでは合成できず、食事から供給されなければなりません。条件付き必須アミノ酸は通常は食事中に必要とされませんが、十分に作られていない個体群には供給されなければなりません。
これらのα-アミノ酸に対して、生合成過程でさらに非必須的に現れるものは構造的に(ここではSMILES表記を用いて)関連しています。
OC(=O)C(N)-OC(=O)C(N)
- │├ C ... 2-アミノブタン酸
- ││├ C ... ノルバリン
- │ │││├ -2H ...So_1F15F プロマーライン(デヒドロノルバリン
- │││├ C ... ノルロイシン
- │ ││├ C(=O)N ...So_1F160 〼グルタミン
- ││├ O ...ホモセリン
- ││ └ S ...ホモシステイン
- │├ C(C)C ...So_1F15B匆々ロイシン
- │├ C(=O)N ... Soc_1F15D糂汰アスパラギン
- │├ C(=O)O ... アスパラギン酸
- │├ c1ccc(O)cc1 ... Socade_1F168 ASB ASBチロシン
- │├ C1=CNc2ccccc12...So_1F166糂汰トリプトファン
- │├ C1=CNc2ccc(O)cc12 ... オキシトリプタン
- │├ c(cc1I)cc(I)c1-O-c2cc(I)c(O)c(I)c2 ... チロキシン
- │└[SeH] ... ソ_1F164セルエンノシステイン
- ├ C(C)C ...So_1F165ヴァランダーライン
- ├ C(C)O ... Socando_1F163 スレンタンスレオニン
- └ C(C)CC ...So_1F158 Iansoredsoleucine
質問と回答
Q: アミノ酸とは何ですか?
A:アミノ酸は、アミン(NH2+R)とカルボキシル(C=O)の両方の官能基を持つ分子で、タンパク質の構成要素である。
Q:真核生物に存在する「標準的な」アミノ酸はいくつあるのか?
A:真核生物には20種類のアミノ酸が存在し、そこからほとんどのタンパク質が作られています。
Q:α-アミノ酸の一般式は?
A:α-アミノ酸の一般式はH2NCHRCOOHで、Rは多くの側鎖のうちの1つです。
Q:生化学ではアミノ酸というと何を指すのですか?
A:生化学では、「アミノ酸」という言葉は、一般式H2NCHRCOOHで表されるα-アミノ酸のことを指し、Rは多くの側鎖のうちの1つである。
Q:タンパク質はどのようにして構造を得ているのですか?
A:タンパク質は、さまざまな種類のアミノ酸の組み合わせによってその構造を獲得しています。
Q:アミノ酸分子の中で、アミンとカルボキシル官能基はどのような役割を担っているのですか?
A:アミン官能基とカルボキシル官能基は、アミノ酸分子を構成する窒素原子と、他の分子と結合できる炭素原子を提供するものです。
百科事典を検索する