カルボカチオン(Carbocation)とは:構造・性質・反応性を分かりやすく解説
カルボカチオンの構造・性質・反応性を図解と例で分かりやすく解説。基礎から応用反応まで学べる入門ガイド。
カルボカチオンとは、正電荷を持つ炭素原子を持つイオンのことである。荷電しているその炭素原子は、通常の中性炭素が持つ8個の価電子(オクテットルール)に対して6個の価電子しか持っていないため不安定で、電子を受け取って安定化しようとする。カルボカチオンは化学反応の中で重要な中間体として振る舞い、他の分子から電子(電子対)を受け取ることで中性に戻る。
構造と電子配置
古典的・単純化した説明では、カルボカチオンの正電荷は空の軌道に由来するとされ、時にsp3混成を伴うと説明されることがある。しかし、より正確には多くの典型的なカルボカチオンはsp2混成を取り、三つのsp2軌道で3本のσ結合(または2本のσ結合+孤立電子対)を作り、残った1つの垂直方向のp軌道は空である。この空のp軌道は基準面に対して垂直で、分子骨格は概ね平面(三角形)に近い構造を示すため、求電子(負電荷を与える電子対)やヌクレオフィルがこの空軌道に攻撃して結合を再生する。
安定性に影響する要因
- アルキル置換効果(ハイパー共役):アルキル基は隣接するC–H結合を通じて空のp軌道と共役し、電子を部分的に分散させカルボカチオンを安定化する。一般に、置換が多いほど(メチル→一次→二次→三級)安定性が高い。
- 共鳴(共役)安定化:ベンジル カルボカチオンやアリル カルボカチオンのように、正電荷が複数の原子に分散できる場合、非常に安定になる。共鳴はアルキル置換による安定化より強力なことが多い。
- 電子引寄/電子供与置換基:電子を供与する基(例:-OR, -NR2)は正電荷を安定化し、電子を引く基(例:-NO2)は不安定化する。
- 誘起効果と溶媒和:極性溶媒や配位能のある溶媒(例:水、アルコール)はカルボカチオンを溶媒分子で安定化できる。反応速度や中間体の寿命に影響する。
- 非古典的・架橋カルボカチオン:2-ノルボルニル陽イオンなど、一部の系では正電荷が一つの炭素に局在せず橋状に分散する「非古典的」構造を取り、これが安定化に寄与する。
分類と代表例
- アルキルカルボカチオン:メチル、一次、二次、三級(一般に三級が最も安定)。
- アリルカルボカチオン:CH2=CH–CH+ のように二重結合に隣接する場合、共鳴で安定化。
- ベンジルカルボカチオン:フェニル基に隣接する正電荷はベンゼン環への共鳴で強く安定化される。
- 芳香族陽イオン(例:トロピリウムイオン):環状系で6π電子の芳香性を持つ場合、非常に安定で独立したイオンとして存在しうる。
- トリフェニルメチル陽イオン(トリチル陽イオン):置換基が多く電子供与的な芳香族環で取り囲まれているため、安定で単離された塩が得られることもある。
生成方法と関与する反応
- ヘテロリシス(C–X結合の切断):ハロゲン化アルキルの溶媒和分解(SN1)で中間的に形成。
- 付加–脱離反応(E1脱離):脱離によって発生し、その後脱プロトン化してアルケン生成に進む。
- アルケンのプロトン化:アルケンに酸が付加すると、カルボカチオンが生成されることがある(マルコフニコフ則に基づく付加反応など)。
- 水素・アルキル抽出(ハイドリド・メチル移動):反応中により安定なカルボカチオンを形成するための再配置(ハイドリドシフト、メチルシフト)が頻繁に起こる。
反応性と機構上の重要性
カルボカチオンは強い求電子種であり、ヌクレオフィルによる捕捉(付加)や、溶媒・陰イオンによる安定化、または再配置を通じて反応経路を決定づける。SN1型置換反応やE1型脱離反応ではカルボカチオンが鍵となる中間体であり、その安定性が反応速度や生成物の分布を大きく左右する。
観測・実験的証拠
- 低温NMR:安定化されたカルボカチオンは低温条件で検出されることがある(例:トリフェニルメチル陽イオンの観測)。
- 色とUV/可視吸収:共役系で安定化された陽イオンは色を示すことがあり、紫外可視分光で特徴的な吸収を持つ。
- 塩としての単離:超弱配位陰イオン(例:SbF6–, BF4–、カルボランアニオンなど)を伴う塩として単離・結晶化される例がある。
- 質量分析・反応速度論:反応中間体としての存在は速度論的データや質量分析断片から支持される。
重要な注意点(ポイント)
- 安定性の一般順序:三級(3°)> 二次(2°)> 一次(1°)> メチル(ただし共鳴やその他の効果により例外あり)。
- 再配置が起こりやすい:より安定なカルボカチオンを形成するためにハイドリドシフトやアルキルシフトが起こるため、生成物予測では再配置を常に考慮する必要がある。
- 非古典イオンの存在:全てのカルボカチオンが単純に一原子に正電荷が局在するわけではない。系によっては架橋構造や分極した共鳴構造をとる。
まとめると、カルボカチオンは有機反応の中で非常に重要な求電子中間体であり、その構造(主にsp2混成・平面構造)、安定化要因(ハイパー共役、共鳴、溶媒効果など)、および再配置の可能性を理解することが、反応機構の予測と制御に不可欠である。
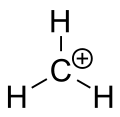
メタンのカルベニウムイオン

平面的な形状を示すtert-ブチルカチオン
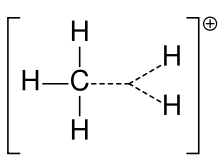
メタンのカルボニウムイオン
定義
カルボカチオンは以前はカルボニウムイオンと呼ばれることが多かったが、化学者はその正確な意味を疑問視している。現在の化学では、正電荷を帯びた炭素原子はすべてカルボカチオンと呼ばれている。カルベニウムイオンは3価、カルボニウムイオンは5価または6価の2つの特殊なタイプが提案されている。大学レベルの教科書では、カルボカチオンをあたかもカルベニウムイオンであるかのように説明したり、カルボニウムイオンやカルベニウム、カルボニウムイオンという古い表現をちらっと使ってカルボカチオンを説明したりしている。ある教科書では、現在でもカルベニウムイオンの古い名称であるcarbonium ionを使い続け、CH5+のためにhyperervalent carbenium ionという言葉を残しています。
歴史
1891年、G.Merlingは、トロピリデン(シクロヘプタトリエン)に臭素を加えて加熱すると、結晶性の水溶性物質であるC
7H
7Brを得た。彼はこの物質の構造を示唆しなかったが、DoeringとKnoxはこの物質が臭化トロピリウム(シクロヘプタトリエニリウム)であることを説得的に示した。このイオンはヒュッケル則によって芳香族であることが予測されている。
1902年、NorrisとKehrmanは、無色のトリフェニルメタノールが濃硫酸で濃い黄色の溶液を作ることを独自に発見した。塩化トリフェニルメチルも同様に、アルミニウムやスズの塩化物とオレンジ色の錯体を形成した。1902年、アドルフ・フォン・バイヤーは、生成した化合物が塩のような性質を持つことを認識した。

彼は、色と塩の形成の関係をハロクロミーと呼び、マラカイトグリーンはその代表例です。
カルボカチオンは多くの有機反応の反応性中間体である。1899年にJulius Stieglitzによって提唱されたこの考えは、1922年にHans MeerweinがWagner-Meerwein転位の研究でさらに発展させた。カルボカチオンは、SN1反応、E1反応、ホイットモア1,2シフトなどの転位反応にも関与していることがわかった。化学界では、カルボカチオンという概念を受け入れようとせず、長い間、アメリカ化学会誌ではカルボカチオンに言及した記事を拒否していた。
溶液中の安定なカルボカチオンの最初のNMRスペクトルは、1958年にDoeringらによって発表された。これは、ヘキサメチルベンゼンを塩化メチルと塩化アルミニウムで処理して作られたヘプタメチルベンゼンニウムイオンであった。安定な7-ノルボルナジエニルカチオンは、1960年にStoryらが二酸化硫黄中でノルボルナジエニルクロリドとテトラフルオロホウ酸銀を-80℃で反応させて調製した。NMRスペクトルから、非古典的に架橋されていることが確認された(初めて安定な非古典的イオンが観測された)。
1962年、オラはフッ化tert-ブチルを魔法の酸に溶かすと、安定な種としてtert-ブチルカルボカチオンが核磁気共鳴で直接観測された。ノルボルニルカチオンのNMRは、Schleyerらによって初めて報告され、Saundersらによって障壁を越えてプロトンスクランブルを起こすことが示された。
プロパティ
有機化学の分野では、カルボカチオンは水酸基やハロゲンイオン−などの求核剤による求核攻撃の対象となることが多い。
カルボカチオンは、イオン化した炭素に結合している炭素原子の数によって、一次、二次、三次に分類される。一次カルボカチオンはイオン化した炭素に結合している炭素の数が1個または0個、二次カルボカチオンはイオン化した炭素に結合している炭素の数が2個、三次カルボカチオンはイオン化した炭素に結合している炭素の数が3個である。
カルボカチオンの安定性は、電荷を持つ炭素に結合しているアルキル基の数が多いほど高くなる。三次カルボカチオンは二次カルボカチオンよりも安定している(形成されやすい)。一次カルボカチオンは非常に不安定である。これは、イオン化した高次の炭素は超共役によって安定化するが、未置換の(一次の)炭素は安定化しないためである。そのため、SN1反応やE1脱離反応のように、一次カルボカチオンが形成されるような反応は通常起こらない。ただし、イオン化した炭素の隣に炭素-炭素二重結合がある場合は例外である。アリルカチオンCH2=2+CH-CHやベンジルカチオン6CH5-CH2+のようなカチオンは、他のほとんどのカルボカチオンよりも安定している。アリルやベンジルのカルボカチオンを形成できる分子は、特に反応性が高い。
カルボカチオンは、109秒を超える速度定数で、安定性の低い構造から同等またはより安定な構造へと転位反応を起こす。このことが、多くの化合物の合成経路を複雑にしている。例えば、3-ペンタノールを塩酸水溶液で加熱すると、最初に生成した3-ペンチルカルボカチオンが再配列して、3-ペンチルと2-ペンチルの統計的混合物となる。これらの陽イオンが塩化物イオンと反応して、約1/3が3-クロロペンタン、約2/3が2-クロロペンタンになります。
ノルボルニルカチオンのようなカルボカチオンの中には、多かれ少なかれ対称的な3中心結合を示すものがあります。この種のカチオンは非古典的なイオンと呼ばれている。古典的」なカルボカチオンと「非古典的」な異性体との間のエネルギー差は非常に小さいことが多く、「古典的」な構造と「非古典的」な構造との間の移行に伴う活性化エネルギーは、あったとしてもほとんどない。2-ブチルカルボカチオンの「非古典」型は、本質的には2-ブテンであり、炭素-炭素二重結合の中心の真上にプロトンが存在することになる。「非古典的」なカルボカチオンは、かつて大きな論争の対象となった。ジョージ・オラーの化学への最大の貢献の1つは、この論争を解決したことである。
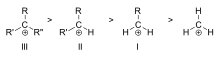
3級アルキル(III)、2級アルキル(II)、1級アルキル(I)のカルボカチオンの例の安定性の順序
特定のカルボカチオン
シクロプロピルカルビニルカチオンはNMRで調べることができます。

ジメチル誘導体のNMRスペクトルでは、2つのメチル基に2つの同等でない信号が見られ、このカチオンの分子構造が垂直(Aの場合)ではなく、空のp軌道とシクロプロピル環系が同一平面上にある二分(Bの場合)であることを示している。

曲がりくねった結合理論の観点からは、充填されたシクロプロパンの曲がりくねった結合と空のp軌道との間に好ましい軌道の重なりがあると仮定することで、この優先順位が説明される。
質問と回答
Q: カルボカチオンとは何ですか?
A: カルボカチオンとは、正電荷を帯びた炭素原子を持つイオンのことです。
Q: カルボカチオンの外側の価電子殻は何ですか?
A: カルボカチオンの外殻には、安定な8個の価電子の代わりに、6個の価電子しかありません。
Q: なぜカルボカチオンは反応しやすいのですか?
A: カルボカチオンが反応しやすいのは、価電子の八重を埋めようとするためと、中性電荷を取り戻そうとするためです。
Q: 炭素原子の最大安定性はどのくらいか?
A: 炭素原子の安定性は、価電子が8個のときに最大となります。
Q: 化学における六重奏とは何ですか?
A: 六重極とは、カルボカチオン中の炭素原子が、安定な8個の価電子の代わりに6個の価電子のみを外殻に持つことを表す用語である。
Q: カルボカチオンの混成と分子形状はどうなっていますか?
A: カルボカチオンは論理的にはsp3混成で、sp3軌道が空であれば正の電荷を持つと考えられますが、その反応性はsp2混成で三角形の平面状の分子形状に近いと言えます。
Q: オクテットルールとは何ですか?
A: オクテットルールとは、原子が他の原子と化学結合を形成する際に、両方の原子が8個の価電子を安定的に持つようにする傾向があるという化学の原理です。
百科事典を検索する