フェノール(C6H5OH)とは:定義・性質・製造法と主な用途
フェノール(C6H5OH)の定義・性質・製造法と主な用途をわかりやすく解説。化学的性質、工業生産、応用例(樹脂・洗剤・農薬)を網羅。
フェノールは、式 C6 H5 OH で表される有機化合物である。白色の固体である。ベンゼン環にOH基(ヒドロキシル基)が結合している。アルコールである。芳香族が電子を引きつけるので、かなり酸性です。フェノールは石油から生産されます。他の多くの製品を作るために使用できるため、重要な分子です。また、洗剤や除草剤にも使用されています。
概要と物理化学的性質
フェノール(英: phenol)は、芳香族の一種で、ヒドロキシル基(–OH)がベンゼン環に直接結合した構造を持ちます。常温では無色から白色の結晶性固体で、空気中で酸化されやすく、淡い赤色や褐色に変色することがあります。
- 分子式・分子量:C6H5OH、分子量 約94.11 g·mol−1
- 融点:約 40.5 °C
- 沸点:約 181.7 °C
- 密度:約 1.06–1.08 g·cm−3(20 °C)
- 水への溶解度:水にやや可溶(約 8.3 g/100 mL @20 °C)で、多くの有機溶媒に良く溶ける
- 酸性度:水中での pKa は約 9.95(室温)で、一般的な一次アルコール(pKa≈16)よりかなり酸性である
化学的性質と反応性
フェノールはヒドロキシル基の影響で、ベンゼン環の反応性が変化します。具体的には次の特徴があります。
- 酸性:フェノールはフェノキシドイオン(PhO−)になると、負電荷がベンゼン環に共鳴で広がり安定化するため、一般的なアルコールより酸性です。電子求引基があると酸性が強く、電子供与基があると酸性が弱くなります。
- 求電子置換反応(EAS):–OH は共鳴による電子供与性により、ベンゼン環を活性化し、主にオルト位およびパラ位への求電子置換が起こりやすくなります(例:ニトロ化、スルホン化、ハロゲン化等)。
- 保護・導入反応:フェノールの–OH は酸により容易にプロトン化・脱離したり、エステル化・エーテル化されたりします。フリーデル–クラフツアルキル化/アシル化は触媒(ルイス酸)と相互作用しやすいため注意が必要です。
- 塩形成:塩基(NaOHなど)と反応して水溶性のフェノキシド塩を生成し、これを利用した合成や中間体の処理が行われます。
製造法(主な工業プロセス)
工業的には以下の方法が主要です。
- クメン法(cumene process):現在、工業生産の主流。ベンゼンをプロピレンとアルキル化してクメン(イソプロピルベンゼン)を作り、これを酸化してクメンヒドロペルオキシドとし、酸触媒で分解(ホック反応)してフェノールとアセトンを得る。一連の工程は効率が良く、アセトンという有用副産物が得られるのが利点です。
- 石炭タール法(歴史的手法):かつては石炭タールの分留・抽出から得られていた。現在でも一部用途や地域で用いられることがある。
- 直接酸化/水酸化法:ベンゼンの直接水酸化や酸化的水酸化を触媒(例:H2O2 と金属触媒)で行いフェノールを得る研究・実用化が進められている(廃棄物・副生成物低減の観点からの改良が続く)。
主な用途
フェノールは多くの化学品や素材の原料であり、用途は非常に広範です。
- フェノール樹脂(フェノール・ホルムアルデヒド樹脂、いわゆるベークライトなど):接着剤、電気絶縁材、成型材料などに利用。
- ビスフェノールA(BPA)合成:フェノールとアセトンから合成され、ポリカーボネート樹脂やエポキシ樹脂の原料となる。
- 医薬品原料:サリチル酸(アスピリンの前駆体)など、さまざまな医薬中間体の合成に使用。
- 農薬・除草剤および界面活性剤の原料:フェノール誘導体は除草剤や洗剤関連化合物の前駆体となる場合がある(例:アルキルフェノール系界面活性剤は問題視されているため規制・代替が進行中)。
- 消毒・防腐剤:フェノールはかつて「カルボリック酸」として消毒・防腐に用いられた歴史がある(現在はより安全な代替物が一般的)。
- 染料・香料・他の有機合成中間体:さまざまな有機合成反応の出発物質として利用。
安全性・取り扱い上の注意
フェノールは有用な化学物質である一方で、危険性も伴います。
- 毒性と腐食性:皮膚や粘膜に対して腐食性があり、皮膚吸収で全身毒性を示すことがある。高濃度では化学熱傷やショック、臓器障害を引き起こす可能性がある。蒸気や飛沫の吸入、経口摂取も有害。
- 作業上の対策:適切な換気、耐薬品手袋、保護衣、ゴーグルを着用すること。作業場には適切な洗眼・洗浄設備を備える。
- 応急処置:皮膚接触時は汚染衣類を脱がせ大量の水で十分に洗い流し、必要に応じて医療機関へ。誤飲や吸入の場合は直ちに医療機関へ搬送する(自己判断で嘔吐させない等、専門家の指示に従う)。
- 消防・漏出対策:火気厳禁。漏洩時は吸収材で回収し、適切に廃棄する。小規模漏洩は希釈して中和(炭酸水素ナトリウム等)などの方法が使われることがあるが、具体的処理は安全データシート(SDS)に従う。
環境影響
フェノールは水生生物に対して有害であり、排水規制の対象となることが多いです。工場排水や廃棄物管理においては処理・分解が重要で、生物学的処理や化学的処理による除去が行われます。また、フェノールの一部誘導体(特にアルキルフェノール類)は環境ホルモン様作用が問題となり、規制や代替技術の導入が進められています。
代表的な関連反応・派生物
- サリチル酸合成(Kolbe–Schmitt反応):フェノキシドを二酸化炭素でカルボキシル化してサリチル酸を得る経路など、医薬中間体合成に利用される。
- ビスフェノールA の合成:フェノールとアセトンの縮合により得られ、プラスチック原料となる。
- フェノールのニトロ化、スルホン化、ハロゲン化による各種化合物の合成。
フェノールは基礎化学工業の重要原料であり、その性質や取扱いを正しく理解することが安全で効率的な利用に不可欠です。詳細な安全情報や法規制については、製品のSDSや各国の規制当局の情報を参照してください。
フェノールの構造
プロパティ
酸味
フェノールはpKaが約10である。通常のアルコールでは、この数値は通常15程度である。しかし、フェノールはカルボン酸のような化合物よりも酸性度が低い。この酸性度が高い理由は、分子が陰イオンになったときに共鳴安定化するためである。
反応
フェノールは求電子的芳香族置換反応をよく行うことができる。これは、酸素原子のローン・ペアがベンゼン環を通して求電子剤に電子を与えることができるからである。しかし、ローンペアはエネルギーが高いので、時々フェノールは何度も反応しすぎる。
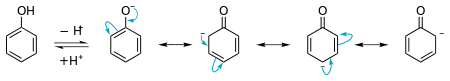
フェノール中の酸素上の孤立対が安定化する様子を示した図。これが酸性を説明する。
歴史
フェノールは1834年に初めて発見された。石炭を燃やしたときにできたものである。最初の用途の1つは、手術中の細菌を殺すことでした。現在でも一部の鎮痛剤に使われている。第二次世界大戦中、フェノールはナチスにも使用されました。彼らは強制収容所で少人数の人々を素早く殺すためにそれを使用しました。
百科事典を検索する