酸とは|化学での定義・性質・強酸と弱酸・pHと塩基
酸とは何か:定義・性質、強酸と弱酸の違い、pHと塩基の関係を図解と日常例でやさしく解説する高校化学の入門ガイド
データベースのある性質についての記事はACIDにあります。
時々酸は薬物LSD(リゼルグ酸ジエチルアミド)の別の名前です。
酸とは、水素イオン(H+)(一般的にはプロトン)を他の物質に供与することができる物質のことです。酸はpHが7.0以下の物質です。水素原子が酸素、窒素、塩素などの電子陰性原子にくっついていれば、化学物質はプロトンを供与することができます。酸には強い酸と弱い酸があります。弱酸はプロトンの一部を保持していますが、強酸はプロトンをすべて放出します。すべての酸は、溶液中に水素イオンを放出します。分子あたりに放出されるイオンの量によって、その酸が弱酸か強酸かが決まります。弱酸とは、付着している水素原子を部分的に放出する酸のことです。これらの酸は、水素イオンの解離によってpHを低下させることがありますが、完全ではありません。弱酸は一般的にpH値が4~6であるのに対し、強酸はpH値が1~3となっています。
塩基は酸の"化学的対極"だ塩基とは、酸の水素原子を受け入れる物質のことです。塩基は、水の中で分裂して水酸化物イオンを放出することができる分子です。
酸の定義(詳細)
酸の定義はいくつかの理論で説明されます。代表的なものを簡単にまとめると:
- アレニウスの定義:水溶液中で水素イオン(H+)を放出する物質を酸とする(例:HCl → H+ + Cl-)。
- ブレンステッド=ローリーの定義:プロトン(H+)を供与する物質を酸、受け取る物質を塩基とする。この定義は水以外の溶媒や気相でも使えます。
- ルイスの定義:電子対を受け取る物質を酸、電子対を供与する物質を塩基とする(ルイス酸の例:BF3、AlCl3)。
強酸と弱酸
強酸は水に溶けたときにほぼ完全に電離し、ほとんどの分子がH+(実際には水和してH3O+)を放出します。代表的な強酸には塩酸(HCl)、硝酸(HNO3)、硫酸(H2SO4、一価目は強酸)などがあります。
弱酸は部分的にしか電離せず、化学平衡が成り立ちます。酢酸(CH3COOH)、炭酸(H2CO3)、リン酸(H3PO4の段階的な解離)などが例です。弱酸の強さは酸解離定数Ka(または対数表示のpKa)で表され、Kaが大きいほど強い酸です。
pH・pOH と酸性度の計算
pHは溶液中の水素イオン濃度を示す指標で、pH = -log[H+] で定義されます。中性の水(25℃)では[H+] = 1.0×10-7 mol/L で、pH = 7です。水の自己イオン化定数 Kw = [H+][OH-] は25℃で約1.0×10-14であり、pH + pOH = 14 になります(温度依存)。
強酸のpHは濃度から直接計算できます(例:0.01 M HCl → [H+] ≈ 0.01 → pH = 2)。弱酸の場合は解離平衡を考え、Kaを用いて[H+]を求めます。近似式や酸の解離度(α)を用いて計算することが一般的です。
多価酸と段階的解離
一つの分子が複数のプロトンを放出する酸を多価酸(多プロトン酸)と呼びます。例えば硫酸(H2SO4)は一価目が強酸、二価目が弱酸として振る舞います。リン酸(H3PO4)は三段階で段階的に解離し、それぞれにKa(pKa)があります。
酸と塩基の関係・中和反応
酸と塩基が反応すると中和が起こり、一般には水と塩が生成されます(例:HCl + NaOH → NaCl + H2O)。ブレンステッドの視点では、酸とその共役塩基、塩基とその共役酸というペアが常に存在します。酸の強さとその共役塩基の塩基性は反比例の関係にあり、Ka と Kb の積は水のイオン化定数 Kw に等しくなります(Ka·Kb = Kw)。
バッファーと指示薬
バッファー(緩衝液)は弱酸とその共役塩基、あるいは弱塩基とその共役酸が混合された系で、外部から酸や塩基を加えてもpHが大きく変化しにくい特徴があります。Henderson–Hasselbalchの式(pH = pKa + log([A-]/[HA]))はバッファーの設計やpH計算に用いられます。
指示薬は色がpHに応じて変化する物質で、酸-塩基滴定で等量点を視覚的に判定するのに使われます(例:フェノールフタレイン、メチルオレンジ)。
実用的な例と日常での酸
- 食品:酢(酢酸)は弱酸、レモンや梅などの柑橘類に含まれるクエン酸も弱酸。
- 工業・試薬:塩酸、硫酸、硝酸は工業的に広く使用される強酸。
- 人体:胃酸は主に塩酸で、消化に重要ですが過剰だと胃潰瘍などの原因になります。
安全と取り扱い上の注意
酸は濃度や種類によって皮膚・眼・呼吸器を損傷する危険があります。特に強酸や酸の飛沫・蒸気には注意が必要です。取り扱う際は適切な保護具(手袋、保護眼鏡、換気)を用い、皮膚に付着した場合は大量の水で速やかに洗い流し、必要なら医療機関を受診してください。
まとめ(ポイント)
- 酸は一般にプロトン(H+)を供与する物質で、pHが低い。
- 強酸はほぼ完全に電離し、弱酸は部分的に電離する。強さはKa(pKa)で表される。
- 酸・塩基の定義はアレニウス、ブレンステッド=ローリー、ルイスといった観点で拡張できる。
- pH計算、バッファー設計、中和反応など酸・塩基の性質は実験・工業・日常生活で重要。

塩酸(ビーカー内)がアンモニアガスと反応して塩化アンモニウム(白煙)を生成する。
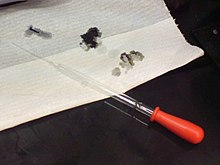
酸は危険です。紙に穴が開いたのは、98%の硫酸を使った溶液である。
酸の働き
酸と塩基は通常、平衡状態で共存しています。これは、酸のサンプルの中で、ある分子がプロトンを放出し、他の分子がプロトンを受け入れることを意味します。水でさえ、酸性イオンであるH3O+(水素イオンと呼ばれる)と塩基性イオンであるOH-(水酸化物イオンと呼ばれる)の混合物です。ヒドロニウムイオンは、そのプロトンを水酸化物イオンに渡し、中性のH2Oの2分子を形成します。この反応は水のサンプル中で連続的に起こりますが、サンプル中には同量のヒドロニウムと水酸化物が存在するため、全体的には中性です。しかし、ほとんどの反応では、酸と塩基が等量に存在しておらず、このアンバランスが化学反応の発生を可能にしています。
すべての酸は、酸のプロトンを除去することによって形成される共役塩基を持っています。例えば、塩酸(HCl)は酸であり、その共役塩基は塩素アニオン、またはCl-です。酸とその共役塩基は強さが逆です。HClは強酸なので、Cl-は弱塩基です。
物件情報
酸には強さの違いがあり、中には反応性の高いものもあります。反応性の高い酸は、より危険な場合が多いです。
酸は、その分子構造によって様々な性質を持っています。ほとんどの酸は以下のような性質を持っています。
- 饐える
- 触れると皮膚を刺すことができる
- 金属や皮膚を蝕む
- は、移動性イオンの存在により、電気分解時の反応物として使用することができます。
- 青いリトマス紙を赤くする
- 普遍的な表示器で赤かオレンジ色にする
- 電気を通す
酸は皮膚を燃やすことができ、火傷の重症度は酸の種類と濃度に応じて異なります。これらの化学熱傷は、直ちに医師の手当てが必要です。
酸は水素イオンを供与するので、すべての酸には水素が含まれていなければなりません。

危険な酸と危険な塩基と一緒に使われている警告画像塩基は酸の反対語です。
重要性
酸は大切なものです。DNAやRNAなどの核酸は、遺伝暗号を含んでいます。これらの分子は、生物の多くの特徴を決定し、親から子孫へと受け継がれます。DNAには、アミノ酸でできたタンパク質をどのように構築するかの計画が含まれています。
脂肪酸および脂肪酸誘導体は、生物学において重要な役割を果たすカルボン酸の別のグループである。これらは、炭化水素の長鎖と一端にカルボン酸基を含む。ほぼすべての生物の細胞膜は、主にリン脂質二重層、極性の親水性リン酸塩「頭」基を持つ疎水性脂肪酸鎖のミセルで構成されています。
ヒトや他の多くの動物では、塩酸は胃の中で分泌される胃酸の一部です。タンパク質や多糖類の加水分解を助けることができます。また、不活性なプロ酵素であるペプシノーゲンを酵素であるペプシンに変換することもできます。一部の生物は防衛のために酸を生産する; 例えば、アリはギ酸を生産し、タコはマグネータと呼ばれる黒酸を生産します。
ほとんどの酸は自然界に存在しています。その中には以下のようなものがあります。
- 酢はおそらく最もよく知られているものの一つで、酢酸が含まれており、それはよく知られている味を与えます。
- 硝酸、NHO3は13世紀頃から知られています。
- クエン酸、C6H8O7は、果物の多くの種類で見つけることができます。彼らはおそらく8世紀にゲバーによって発見されました。
- 乳酸、C3H6O3 は 1780 年に Carl Wilhelm Scheele によって見つけられました。それはヨーグルトのような酸っぱい乳製品で、見つけることができる。
- 硫酸、H2SO4は、おそらくゲッバーによって発見されました。今日では電池にも含まれています。
関連ページ
- アルカリ
- 葉酸
質問と回答
Q:ACIDとは何ですか?
A:ACIDは、データベースのある特性に関する記事です。
Q: 一般的に、酸とは何ですか?
A: 一般的に酸とは、水素イオン(H+)を他の物質に与えることができる物質で、pHは7.0未満です。
Q: 化学物質がプロトンを供与できる条件とは?
A: 化学物質がプロトンを供与できるのは、水素原子が酸素、窒素、塩素のような電気陰性原子に結合している場合です。
Q: 強酸と弱酸の違いは何ですか?
A: 強酸はプロトンをすべて放出し、弱酸はプロトンの一部を保持しています。1分子あたりに放出されるイオンの量によって、その酸が弱いか強いかが決まります。
Q: 弱酸と強酸のpHの範囲は?
A: 弱酸は一般的にpH値が4~6で、強酸はpH値が1~3です。
Q: 塩基とは何ですか?
A: 塩基は、酸の "化学的な反対語 "です。塩基とは、酸の水素原子を受け入れてくれる物質のことです。塩基は、水中で分裂して水酸化物イオンを放出することができる分子です。
Q: LSDとは何ですか?
A: LSD (Lysergic acid diethylamide)は、酸のように言われることもある薬物ですが、この記事で紹介した酸とは関係ありません。
百科事典を検索する