テロメラーゼとは?定義・機能・発見・テロメア維持と老化・がん
テロメラーゼの定義・仕組み・発見史から、テロメア維持と老化・がんの関係まで基礎と最新研究を分かりやすく解説。
テロメラーゼは、酵素であるRNAタンパク質である。テロメア領域のDNA鎖の末端にDNA配列の繰り返し(脊椎動物では「TTAGGG」)を付加する。
テロメアは、真核生物の染色体の末端をブロックする使い捨てのバッファである。テロメアは、ノンコーディングDNAを含む繰り返しヌクレオチドの領域です。テロメアは細胞分裂の際に破壊され、テロメラーゼという酵素によって作り直される。
テロメアの働きは、染色体の末端から重要なDNAが失われないようにすることです。染色体がコピーされるたびに100~200個の無意味なヌクレオチドが失われ、生物のDNAにダメージを与えることはありません。そのため、テロメアは複製のたびに短くなり、テロメラーゼによって適切な長さに復元されます。テロメラーゼは独自のRNA分子を持ち、これを鋳型としてテロメアを伸長させます。
テロメア短縮の代償メカニズム(「修正」)の存在は、1973年にソ連の生物学者アレクセイ・オロフニコフによって最初に予測されました。彼はまた、老化のテロメア仮説やテロメアと癌との関連性を示唆しました。
テロメラーゼは、1984 年にキャロル・グライダーとエリザベス・ブラックバーンによって、繊毛動物テトラヒメナで発見されました。グレイダーとブラックバーンは、この発見により、ジャック・ゾスタックとともに2009年ノーベル生理学・医学賞を受賞しました。
テロメラーゼの構造と分子機能
テロメラーゼはタンパク質とRNAからなるリボヌクレオタンパク質(RNP)複合体です。主要構成要素は触媒サブユニットであるテロメラーゼ逆転写酵素(TERT)と、鋳型となるテロメラーゼRNA(TERC, ヒトではhTR)です。TERTは逆転写酵素ドメインを有し、TERCの短い配列を鋳型として繰り返し配列をDNA末端に付加します。
テロメラーゼの作用は、いわゆる「末端複製問題(end-replication problem)」を補うことです。通常、DNAポリメラーゼは一本鎖のRNAプライマーを必要とし、ラギング鎖の最後端ではプライマーを置き換えられないため毎回短縮が起こります。テロメラーゼはこの短縮を部分的に補い、染色体末端の安定性を維持します。
テロメアと保護因子(シェルタリン複合体)
テロメアは単なる配列繰り返しではなく、TRF1、TRF2、POT1、TIN2、TPP1、RAP1などからなる〈シェルタリン(shelterin)〉と呼ばれるタンパク質複合体により保護されています。これらのタンパク質はテロメア末端を「本物のDNA切断(double-strand break)」と認識されないように覆い、不要なDNA修復や染色体末端の融合を防ぎます。テロメラーゼのアクセスや作用もシェルタリンの動的な制御を受けます。
発見と歴史的背景
1970年代にオロフニコフが理論的に提案した後、1984年にキャロル・グライダーとエリザベス・ブラックバーンが繊毛虫(テトラヒメナ)で実際にテロメラーゼ活性を検出しました。この発見はテロメア生物学の扉を開き、後続の研究でヒトや他の真核生物におけるテロメラーゼ成分や調節機構が解明されていきました。これらの業績により2009年にノーベル賞が授与されました。
テロメラーゼ、老化、そして細胞寿命
テロメア短縮は細胞の分裂回数に伴って進み、一定の短さに達すると細胞は分裂を停止(複製老化=レプリケティブ・セネッセンス)します。この機構はがん化の抑制装置の一つと考えられていますが、同時に組織の再生能力低下や老化現象に寄与するとされます。生殖細胞や一部の幹細胞、活発に分裂する組織ではテロメラーゼ発現が高く、テロメア長が維持されています。
一方で、テロメラーゼ活性を人工的に高めることにより一部の老化指標が改善するという報告や、逆にテロメア短縮を抑える治療の安全性と有効性に関する議論・研究も進んでいます。市場にはテロメラーゼ活性化を謳うサプリメント(例:TA-65など)も存在しますが、臨床的な証拠や長期安全性には慎重な評価が必要です。
がんとの関係
多くのがん細胞ではテロメラーゼが再活性化されており、無限増殖の一因となっています。実際にヒト腫瘍の大部分でTERTの発現上昇やTERTプロモーター変異(メラノーマや神経膠腫などで頻度が高い)が報告され、テロメラーゼ活性の獲得ががん発生や進展に重要であることが示されています。
ただし、全てのがんがテロメラーゼに依存しているわけではなく、一部の腫瘍は「ALT(alternative lengthening of telomeres)」と呼ばれる相同組換えを用いたテロメア伸長機構を利用します。これらは治療戦略を考える上で重要な違いです。
臨床・研究応用と治療法
- 診断・研究:テロメラーゼ活性はTRAPアッセイなどで検出され、がんバイオマーカーとして研究されています。
- 治療標的:テロメラーゼ阻害剤(例:イメテルスタットなど)や、TERTを標的としたワクチン療法、アンチセンス戦略が開発・臨床試験されています。ただし、正常な幹細胞への影響や副作用の問題が課題です。
- 老化対策の可能性:テロメアの維持やテロメラーゼ活性化による組織再生促進の研究は進んでいますが、がん化リスクとのトレードオフがあり慎重な検討が必要です。
測定法とモデル生物
テロメア長やテロメラーゼ活性の測定は研究・診断で広く用いられます。代表的手法にTRAPアッセイ(telomeric repeat amplification protocol)、Southern法によるテルモア長の評価、qPCR法による相対長測定などがあります。モデル生物としてはテトラヒメナ、酵母、マウス、ヒト培養細胞がよく使われ、各系でテロメラーゼの機能や制御機構の理解が深まっています。
まとめ
テロメラーゼは染色体末端の保護と再構築に不可欠な酵素であり、老化やがんと深く関わっています。基本的な分子機構は解明が進んでいますが、臨床応用(がん治療、老化対策)にはまだ多くの課題と倫理的・安全性の検討が残されています。今後もテロメア生物学は基礎・応用の両面で注目され続ける分野です。
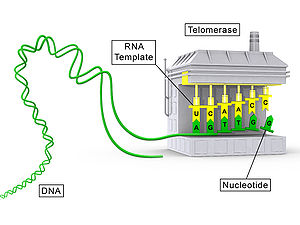
テロメラーゼ(TERT)のタンパク質成分を灰色で、RNA成分(TR)を黄色で示した概念図。
質問と回答
Q:テロメラーゼとは何ですか?
A:テロメラーゼはRNAタンパク質の酵素で、テロメア領域でDNA鎖の末端にDNA配列の繰り返しを付加します。
Q: テロメアとは何ですか?
A: テロメアは、真核生物の染色体の末端をブロックする使い捨ての緩衝材です。テロメアは、非コード化DNAを含む繰り返しヌクレオチドで構成されています。
Q: テロメアの機能は何ですか?
A: テロメアの機能は、染色体末端から重要なDNAが失われるのを防ぐために、複製サイクルのたびに失われる100〜200個の無意味なヌクレオチドを補うことである。
Q: テロメア短縮の補償機構を最初に予測したのは誰ですか?
A: 1973年にソ連の生物学者アレクセイ・オロフニコフがテロメア短縮の補償機構を初めて予言した。
Q:テロメラーゼを発見したのは誰ですか?
A: キャロル・グライダーとエリザベス・ブラックバーンが1984年に繊毛虫のテトラヒメナでテロメラーゼを発見しました。
Q: グライダー、ブラックバーン、ソスタックの3人は何のために受賞したのですか?
A: グライダー、ブラックバーン、ソスタックの3人は、テロメラーゼの発見により、2009年のノーベル生理学・医学賞を受賞しています。
Q: テロメラーゼはどのように働くのですか?A: テロメラーゼは、自身のRNA分子を持ち、複製サイクルごとに短くなったテロメアを伸ばすための鋳型として働きます。
百科事典を検索する