キレトロピック反応とは:定義・機構・代表例を分かりやすく解説
キレトロピック反応の定義・機構・代表例を図解で丁寧解説。メカニズムや生成物、押し出し反応の実例まで初心者にも分かりやすく紹介。
キレトロピック反応(cheletropic reaction)は、試薬の一方の原子が同時に2つの新しい結合を形成するタイプのペリシクル反応です。ペリシクル反応とは、原子の環状配列とそれに対応する軌道の環状配列をもつ遷移状態を経る反応で、σ結合とπ結合の再編成が環状に進行します。キレトロピック反応では、特に「両方の結合が同じ原子に作られる」ことが特徴で、通常は縮重した(同一原子に集中した)結合形成が一度に起きる協奏的な過程です。
機構の要点
キレトロピック反応は基本的にペリシクル反応の原理に従い、遷移状態における軌道の位相と対称性によって「許容/不許容」が決まります(Woodward–Hoffmann則の適用)。一般に次の点が重要です。
- 協奏的(コンサート)経路:多くは一段階の遷移状態を経る同時形成で、ラジカル中間体を経ないため立体特異性を保持しやすい。
- 軌道相互作用:反応するπ系と、結合を作る原子側のσ軌道や孤立電子対の位相が整合する必要がある。これが整っていれば反応は軌道対称性的に「許容」となる。
- 多様な電子状態:試薬の電子状態(例えば単一項のカルベンか三重項カルベンか)により経路が変わる。単一項カルベンでは協奏的な付加(立体選択的)が起きやすく、三重項カルベンでは逐次的なラジカル経路になり得る。
立体化学と選択性
協奏的なキレトロピック付加はしばしば立体特異的(stereospecific)で、基質の幾何が生成物に反映されます(例:シス/トランスアルケンからのシス/トランス保存)。ただし、電子状態や溶媒、温度によっては逐次経路や回転を伴い立体化学が崩れる場合もあります。
代表例
- カルベンのアルケンへの付加(シクロプロパン形成):単一項カルベンがアルケンの両側に同時に結合してシクロプロパン環を作る反応は、典型的なキレトロピック付加の例です。単一項カルベンでは立体選択的に進行しますが、三重項カルベンではラジカル機構を取り得ます。
- 二重付加/脱離での小分子放出(キレトロピック押し出し/押出反応):例えば、ある環状前駆体から一酸化炭素(CO)や窒素(N2)などの小さな安定した分子が一度に放出される反応はキレトロピックな押し出しと呼ばれます。これらは生成する小分子の体積的自由度が増えるため、しばしば熱動力学的にエントロピー的な利得を受けて進行します。
- 二量化や付加でのSO2の付加/脱離:ジエンと二酸化硫黄(SO2)の付加でスルホレン(sulfolene)を与える反応や、逆にスルホレンからSO2を放出してジエンを与える反応は、キレトロピック付加/押出の良い例です。
- 金属錯体のカルボニル脱離など:特定の有機金属反応でも、単一の原子または小分子が同時に2点の結合を切断・形成して放出されるような過程が観察され、キレトロピックとして説明されることがあります(例:一部の脱炭酸や脱離反応でCOが放出される場合など)。
反応条件と駆動力
キレトロピック反応は温度や光(光誘起で軌道占有が変化する場合)によって進行性や機構が変わります。熱的に進行する場合、しばしばエントロピーの寄与(小分子放出による自由度増加)が駆動力となり、可逆的に付加/押出が観察される系もあります。
実務上のポイント
- 合成化学では、カルベン付加によるシクロプロパン合成や、SO2付加/脱離を利用した保護・脱保護—逆反応の戦略などに応用されます。
- 立体化学を制御したい場合は、反応物の幾何、カルベンの電子状態、溶媒および温度を適切に設計することが重要です。
- 機構解析には速度論、立体化学解析、同位体効果、DFT計算などが有用で、軌道の位相や遷移状態構造の検討によって反応性を説明できます。
まとめると、キレトロピック反応はペリシクル反応の一形態で、同一原子に同時に二つの結合が形成(あるいは切断)される協奏的な過程を指します。軌道対称性と電子状態が反応の可否や選択性を決め、COやN2のような小さな分子放出が駆動力となることが多い点が特徴です。

図1.ペリシクル反応
理論解析
チェレトロピック反応は、その分子の形状から、理論化学者の多くの予測を裏付けるものである。チェレトロピック反応は、分子軌道の対称性が保たれていることを確認する。
pericyclicな遷移状態では、小分子が環に2つの電子を供与する。この反応を説明するには、2つの可能なジオメトリーがあります。小分子は、直線的にも非直線的にも接近することができる。直線的なアプローチでは、小分子の軌道上の電子は、大分子のπ系に直接向けられる。一方、非線形的なアプローチでは、軌道が少しずれた角度で接近します。小分子の接近に伴ってπシステムが回転することは、新しい結合を形成する上で非常に重要である。回転の方向は、π電子が何個あるかによって異なります。フロンティア分子軌道を用いて、2電子のフラグメントが4電子のπシステムに接近する図を以下に示します。小分子が直線的に接近する場合はdisrotatory、非直線的に接近する場合はconrotatoryの回転となる。disrotatoryとconrotatoryは、π系の結合がどのように回転しているかを表しています。disrotatoryは逆方向、conrotatoryは同じ方向を意味します。これは下の図にも示されている。
Huckel's Ruleを用いると、π系が芳香族系か反芳香族系かがわかります。芳香族系であれば、直線的なアプローチでは逆回転運動、非直線的なアプローチでは逆回転運動をします。反芳香族系の場合は逆になります。直線的なアプローチでは回転運動、非直線的なアプローチでは回転しない運動になります。
SOが関与するcheletropicな反応2
熱力学
二酸化硫黄とブタジエン、イソプレンを反応させると、2種類の製品ができる。何が作られるかは、反応メカニズムによって決まります。動力学的生成物と熱力学的生成物の両方が考えられます。熱力学的生成物は、運動論的生成物よりも多く作られます。動力学的生成物はディールス-アルダー反応によるものであり、クレトロピック反応ではより熱力学的に安定した生成物が作られる。cheletropic経路は、より安定した5員環付加物を作るため、より多く使用されます。下の図は、この2つの生成物の違いを示しています。左側の経路は熱力学的な生成物、右側の経路は動力学的な生成物を示しています。SuarezとSordoは1995年にこのことを示しました。彼らは、実験とガウス計算の両方でこのことを示した。
キネティクス
その一例が、1,3-ジエンと二酸化硫黄のキレート反応である。化学者はこの反応の速度論を注意深く見てきた。1976年、IsaacsとLailaは、ブタジエン誘導体への二酸化硫黄の付加反応の速度因子を測定した。30℃のベンゼン中で、最初に20倍のジエンを添加して、添加速度をモニターした。彼らは、分光光度計を用いて320nmの光を調べ、SO2の消失を測定した。反応は「疑似一次速度論」を示した。化学者たちは、ジエンに電子吸引性の基があると、反応速度が低下することを発見した。また、2置換基の立体効果によっても反応速度が大きく影響され、嵩高い基ほど反応速度が大きくなることがわかった。(つまり、2番目の炭素原子からぶら下がっている原子群が大きいほど、反応速度が速くなったのである)。これは、反応に不可欠なジエンのシソイド構造を、嵩高い基が好む傾向があるためだと考えられる(以下の表を参照)。さらに、7つのジエンについて、4つの温度での反応速度を測定した。これらの測定結果から、化学者はアレニウス式を用いて各反応の活性化エンタルピー(Δ‡H)と活性化エントロピー(Δ‡S)を算出した。これは、キレートロピック反応のケネティックスを研究した最初の重要な試みの1つである。
| -ブタジエン | 104k /min−1 (30 °C) (± 1-2%) アブソリュート | 104k /min−1 (30 °C) (± 1-2%) 相対値 | ΔH ‡/kcal mol−1 | ΔS ‡/cal mol−1 K −1 |
| 2-メチル | 1.83 | 1.00 | 14.9 | -15 |
| 2-エチル | 4.76 | 2.60 | 10.6 | -20 |
| 2-イソプロピル | 13.0 | 7.38 | 12.5 | -17 |
| 2-tert-butyl | 38.2 | 20.8 | 10.0 | -19 |
| 2-ネオペンチル | 17.2 | 9.4 | 11.6 | -18 |
| 2-cloro | 0.24 | 0.13 | N/A | N/A |
| 2-ブロモエチル | 0.72 | 0.39 | N/A | N/A |
| 2-p-tolyl | 24.7 | 13.5 | 10.4 | -19 |
| 2-フェニル | 17.3 | 9.45 | N/A | N/A |
| 2-(p-ブロモフェニル) | 9.07 | 4.96 | N/A | N/A |
| 2,3-ジメチル | 3.54 | 1.93 | 12.3 | -18 |
| シス-1-メチル | 0.18 | 0.10 | N/A | N/A |
| トランス-1-メチル | 0.69 | 0.38 | N/A | N/A |
| 1,2-ジメチレン-シクロヘキサン | 24.7 | 13.5 | 11.4 | -16 |
| 2-メチル-1,1,4,4-d4 | 1.96 | N/A | N/A | N/A |
Monnat、Vogel、Sordoの3人は、2002年に1,2-ジメチルリデンシクロアルカンへの二酸化硫黄の付加反応のカイネティクスを測定した。彼らは、1,2-ジメチルイデンシクロヘキサンと二酸化硫黄の反応は、反応条件によって2つの異なる生成物が得られることを記している。この反応は、速度論的な制御下(≦-60℃)ではヘテロDiels-Alder反応によって対応するスルチンを作るが、熱力学的な制御下(≧-40℃)では、cheletropic反応によって対応するスルホレンを作るのである。ヘテロ・ディールス・アルダー反応の活性化エンタルピーは、対応するチェレトロピック反応の活性化エンタルピーよりも約2kcal/mol小さくなっています。スルフォレンは、CHCl22/2SO水溶液中で等モルのスルチンよりも約10kcal/mol安定である。
著者らは、1,2-ジメチルイデンシクロヘキサンと二酸化硫黄の反応で、対応するスルホレンを得るための261.2Kでの速度則を実験的に求めることができた。この反応は、1,2-ジメチルイデネシクロヘキサンでは一次反応であるが、二酸化硫黄では二次反応であった(下記参照)。これは、高レベルの第一原理量子計算に基づく理論化学者の予測を裏付けるものであった。著者らは、計算手法を用いて、1,2-ジメチルイデンシクロヘキサンと二酸化硫黄のキレートロピック反応の遷移構造を提案した(右図)。この反応は二酸化硫黄では二次的に起こるが、これは二酸化硫黄の別の分子が遷移状態を安定化させるために結合していると考えられるからである。同様の結果は、1995年にSuarez、Sordo、Sordoが行った研究でも見られた。この研究では、第一原理計算を用いて、二酸化硫黄と1,3-ジエンの反応の速度論的および熱力学的制御を研究した。
d [ ] 3d t = k 21[ ] [ S O ] {\\}{22d[3]}{dt}}=k_{2}[1][SO_{2}]^{2}}。
溶剤の影響
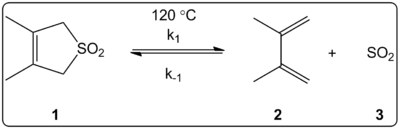
3,4-ジメチル-2,5-ジヒドロチオフェン-1,1-ジオキシドのキレート反応(右図)の溶媒の影響を,14種類の溶媒を用いて速度論的に調べた。その結果,平衡定数に加えて,正反応と逆反応の反応速度定数は,ET(30)溶媒極性スケールと線形相関することがわかった。
反応は120℃で行い、反応混合物の1H-NMR分光法で調べた。順方向の速度kは、1シクロヘキサンからメタノールになるにつれて4.5倍に減少することがわかった。逆方向の速度k-1は、シクロヘキサンからメタノールへの変化により53倍に増加し、平衡定数Keqは140倍に減少した。平衡定数と動力学データの関係から、活性化の過程で極性が変化していることが示唆された。著者らは、反応は溶媒の極性に影響されるようであり、このことは、反応物から遷移状態、生成物へと移行する際の双極子モーメントの変化によって示されると述べている。また、著者らは、キレートロピック反応は、溶媒の酸性度、塩基性度のいずれにも影響されないようだと述べている。
この研究の結果から、著者は次のような行動を期待しています。
1.溶媒の極性の変化は、平衡状態よりも速度に影響を与える。
2.ET(30)の増加に伴い、k1はわずかに減少し、同じ条件であればk-1は増加するというように、速度定数は極性によって逆の影響を受けるという特徴がある。
3.k-1に対する影響の方が大きくなります。

1,2-ジメチルイデンシクロヘキサンとSO2との反応で、速度論的にはヘテロ・ディールス・アルダー反応でスルチンを、熱力学的にはチェレトロピック反応でスルホレンを得ることができる。

1,2-DimethylidenecyclohexaneとSO2のチェレトロピック反応によるスルホレン生成のための遷移状態の提案
様々な溶媒を用いたチェレトロピック反応の研究
アルケンへのカルベン付加反応
合成上最も重要なキレトロピック反応の一つは、アルケンに一重項カルベンを付加してシクロプロパンを作ることである(左図参照)。カルベンとは、価電殻に6個の電子を持つ2価の炭素を含む中性の分子である。このため、カルベンは反応性の高い求電子物質であり、反応の中間体として生成される。一重項カルベンには、空のp軌道と、2個の電子を持つほぼsp2のハイブリッド軌道が存在する。一重項カルベンは、アルケンに立体特異的に付加し、シクロプロパンの生成物にはアルケンの立体化学が保持される。カルベンがアルケンに付加するメカニズムは、協奏的な[2+1]付加環化反応である(図参照)。クロロホルムやブロモホルムから得られるカルベンを用いると,アルケンにCX2を付加してジハロシクロプロパンを得ることができ,Simmons-Smith試薬ではCH2.
充填されたカルベン軌道とアルケンπ系との相互作用により、4電子系が形成され、非線形アプローチが有利になります。また、カルベンの空のp軌道とアルケンの満たされたπ軌道を混ぜるのも好ましい。混ぜる場合は、非線形アプローチが有利です(右図2参照)。しかし、理論的には非線形アプローチが有利であることは明らかですが、実験的には線形アプローチと非線形アプローチの明確な違いはありません。

アルケンにカルベンを付加してシクロプロパンを作る

図2.A) 一重項カルベンの軌道 B) a) カルベンの sp2 軌道と b) カルベンの p 軌道の非線形アプローチ
質問と回答
Q:ケレトロピック反応とは何ですか?
A:ケレトロピック反応はペリシクル反応の一種で、試薬の片方の原子が2つの新しい結合を得る反応です。
Q: 周期的反応とは何ですか?
A: 周期的反応とは、原子の環状配列とそれに伴う相互作用軌道の環状配列を持つ遷移状態を伴う反応で、その中でَとً結合の再編成が行われるものである。
Q:他のタイプの反応とどう違うのですか?
A: チェレトロピック反応は環化付加反応の亜流であり、他のタイプの反応と異なる点は、試薬の一方では、両方の新しい結合が同じ原子に作られている点です。
Q: 具体的にどのような例があるのですか?
A: 例えば、カルボニル基の単原子が一酸化炭素で終わるような「ケレトロピックエクストルージョン」などがあります。
Q:これらの反応の駆動力は何ですか?
A: これらの反応の駆動力は、多くの場合、気体(COやN2など)を放出することによるエントロピー的な利益です。
Q: 図1は、ケレトロピック反応と関係があるのですか?A: はい、図1はケレトロピック反応の例を示しています。
百科事典を検索する
![{\displaystyle {\frac {d[3]}{dt}}=k_{2}[1][SO_{2}]^{2}}](https://www.alegsaonline.com/image/a02f69dd0783356fbf24499f57d0df29cd264f16.svg)