シグマトロピック反応とは — 定義・機構・主要再配列([3,3]コープ等)
シグマトロピック反応の定義・機構、無触媒の転位メカニズムを解説。代表的な[3,3]コープ再配列やクライセン、キャロル、フィッシャー反応のポイントを詳述。
有機化学におけるシグマトロピック反応は、過環式反応である。シグマトロピック反応は触媒を使用せず、単一の分子(無触媒の分子内プロセス)を巻き込みます。それは、1つのσ-結合を別のσ-結合に変更します。シグマトロピックという名前は、単一の炭素-炭素結合のための長い間確立された"シグマ"の名前と、ターンを意味するギリシャ語の単語トロポス、の複合体の結果である。これは転位反応であり、分子内の結合が原子間でシフトすることを意味しますが、これは原子が離れたり、分子に新しい原子が追加されたりすることはありません。シグマトロピック反応では、π系の同時転位を伴う分子内反応で、置換基がπ結合系のある部分から別の部分に移動します。真のシグマトロピック反応は通常、触媒を必要としません。いくつかのシグマトロピック反応はルイス酸によって触媒されます。シグマトロピック反応は、多くの場合、類似の反応で中間体を形成する遷移金属触媒を持っています。シグマトロピックな再配列の中で最もよく知られているのは、[3,3] コープ再配列、クライセン再配列、キャロル再配列、およびフィッシャーインドール合成である。
定義と基本的な特徴
シグマトロピック反応は、複数のπ電子系が関与する分子内の過環式(pericyclic)反応の一種で、あるσ結合(シグマ結合)が分子内で別の位置へ「移動」する過程を指します。重要な点は、反応が基本的に協奏的(同時的、連続的)であり、原子そのものは分離・付加されず、結合の再配置だけが起こることです。
反応機構と選択則(Woodward–Hoffmann則)
シグマトロピック反応の可否や立体化学は、分子軌道の対称性に基づくWoodward–Hoffmann則で説明できます。反応は熱的活性化または光励起のいずれかで進行し、それぞれで「suprafacial(同一面での移動)」か「antarafacial(反対面での移動)」かが重要です。
- [i,j]表記:シグマトロピック移動は一般に [i,j] と表され、移動前後のπ系の原子数の差などで分類されます(例:[1,5]-水素移動、[3,3]-再配列など)。
- 電子数と遷移状態:6電子の過程(例:[3,3])は熱的にはHückel(4n+2)電子に相当し、suprafacial–suprafacialで進行しやすい一方、4電子過程は熱的には不利で光励起やantarafacial経路が関与することがあります。
- 光励起の効果:光励起(光化学的条件)では軌道位相が変わり、熱条件と逆の選択性を示す場合があります。
主要な再配列と具体例
- [3,3]コープ(Cope)再配列:1,5-ジエン系で起こる典型的な6電子過程。遷移状態はしばしば椅子型/反椅子型に類似し、立体化学が保存されることが多い。
- クライセン(Claisen)再配列:エノールエーテルなどで観察され、[3,3]型でカルボニル隣接部位に結合が移動します。酸触媒や金属触媒で活性化されることがある。
- オキシーコープ、アシル化を伴う変種:酸素含有基を持つ系で特に重要。Ireland–Claisenなどの誘導体も合成で多用されます。
- キャロル(Carroll)再配列、フィッシャー・インドール合成:それぞれ特定の出発物質から骨格再構築を行う実用的な手法です。
- 水素シグマトロピック移動([1,5]Hなど):水素原子の移動はしばしば見られ、分子内でのプロトン移動やラジカル性経路と競合することがあります。
立体化学と反応の選択性
シグマトロピック反応は多くの場合立体化学的に特異(stereospecific)です。移動がsuprafacialで進行すると元の位相関係が保たれ、antarafacialでは反転が生じます。例えばクライセンやコープの遷移状態の幾何学(椅子様/舟様)によって、生成物の立体配置が決定されます。
条件・触媒・例外
- 典型的には熱条件で進行するが、光によって反応経路が変わる場合がある。
- 「真の」シグマトロピック反応は触媒を必要としないことが多いが、ルイス酸や遷移金属が活性化や選択性制御に用いられることがある(例:金属に配位して軌道エネルギーを変えることで反応が促進される)。
- 条件によっては完全に協奏的ではなく、ラジカルやイオン性の中間体を経る逐次反応が現れることもある。反応が可逆で熱力学的支配になる場合、生成物は熱的安定性に依存する。
合成上の重要性
シグマトロピック反応は骨格再構築、炭素-炭素結合形成、官能基の位置移動などに広く利用され、天然物合成や複雑分子の合成戦略において強力なツールです。反応の高い立体選択性と可逆性は、望ましい立体化学や芳香族安定化を利用した合成設計に役立ちます。
まとめ
シグマトロピック反応は、分子内でσ結合がπ系を介して移動する協奏的な過程であり、Woodward–Hoffmann則に従った軌道対称性が反応性と立体化学を支配します。代表的な再配列として[3,3]コープやクライセンがあり、合成化学で広く応用されます。条件や置換基、触媒の有無によっては経路や選択性が変わるため、実験設計では軌道論的考察と熱力学・立体化学の両面を考慮することが重要です。
シグマシフトの概要
ウッドワードホフマンシグマトロピックシフト命名法
シグマトロピックシフトを記述するために特別な表記法が用いられている。分子のバックボーン上の炭素原子にはそれぞれ位置番号が割り当てられています。シグマトロピックな再配列は次数項[i,j]によって記述されます。これは、1つ以上のπ系に隣接するσ-結合が、σ-結合の元の位置から取り除かれた新しい位置(i-1)および(j-1)原子へと移動することを意味する。iとjの和が偶数の場合、これは中性の全C原子鎖が関与していることを示している。奇数の場合は、荷電したC原子、または炭素-炭素二重結合を置換するヘテロ原子のローン・ペアが存在することを示唆しています。したがって、[1,5]と[3,3]のシフトは、対称性の考慮を維持しつつ、ヘテロ原子を含む[1,4]と[2,3]のシフトになります。第3の例では、明確にするために、水素は省略しています。

ここで、与えられたシグマトロピックな転位の順序を求める方法を紹介します。まず、原子1として壊れた結合の原子から始まる各原子に数字を与え、化学者は壊れた結合から生成物中の新しいσ結合を形成する原子までの各方向の原子を数える。そして、新しい結合を形成する原子に対応する数をカンマで区切ってカッコの中に入れます。これにより、シグマトロピック反応秩序記述子が作成されます。
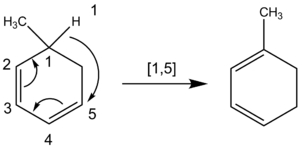
化学者は、水素原子が移動するシグマトロピックシフトを命名する際にも原子を数える。水素原子の移動では炭素鎖は切れません。そのため、化学者は、最も近い原子だけではなく、反応に関与するすべての原子を数えます。例えば、次の水素原子の移動は、時計回りに数えると間違った結果になる環状CH2基を通る[1,3]オーダーではなく、π系を通って反時計回りに数えることによって達成されたオーダー[1,5]です。
上顔面と下顔面のシフト
化学者は、移動基が立体中心を持つシグマトロピック反応を研究してきました。原理的には、すべてのシグマトロピックシフトは、移行基のジオメトリが同じ(保持)か反対(反転)かのどちらかで起こりうる。これは、移行する原子の元の結合ローブと他のローブのどちらが新しい結合を形成するために使用されるかに依存する。
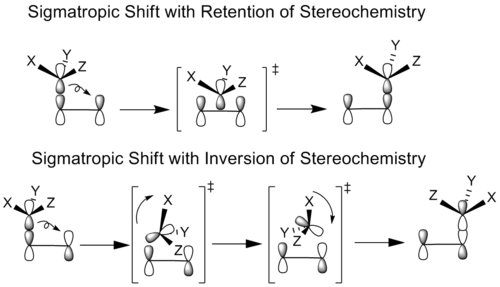
立体化学的保持の場合、移動基は回転せずに結合位置に並進する。立体化学的逆転の場合には、移動基は回転と並進の両方を行い、結合したコンフォメーションに到達する。
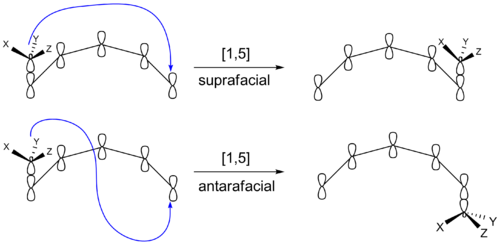
シグマトロピック反応が異なる立体化学的な生成物を生成するもう一つの方法があります。移動基は再結合後もπ系の元の面に留まることができます。また、π系の反対側の面に移動することもできます。このような場合には、π系とは異なる面に移動することが知られています。このような場合には、π系の中でも特に、π系とは反対側の面に移動することを反顔面移動と呼びます。小・中環内で発生した変態は反顔面移動をすることができません。
シグマトロピック再配置のクラス
1,3] シフト
熱ヒドリドシフト
熱的な[1,3]水素化物のシフトでは、水素化物は3つの原子を移動する。Woodward-Hoffmannの法則では、このようなシフトは逆位相シフトで進むことになる。このようなシフトは対称性が許されていますが、遷移状態で必要とされるメビウスのトポロジーはこのようなシフトを禁止しています。幾何学的に不可能である。これが、酸や塩基触媒なしではエノール類が異性化しない理由です。
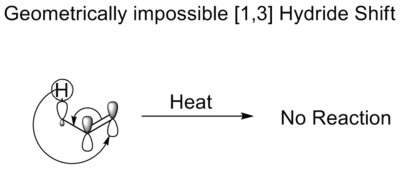
熱アルキルシフト
熱的なアルキル[1,3]シフトは、[1,3]水素化物シフトと同様に、反芳香族的に進行しなければならない。遷移状態の幾何学的形状は禁止的である。しかし、アルキル基は、その軌道の性質上、その幾何学的形状を反転させ、sp3軌道のバックローブと新しい結合を形成することができます。この反応は、上面シフトをもたらす。これらの反応は、遷移状態の高度に秩序化された性質のため、開放鎖系ではまだ一般的ではありません。そのため、この反応は環状分子の中でよりよく働く。
![[1,3] Alkyl Shifts](https://www.alegsaonline.com/image/550px-1,3alkylfixed.png)
光化学的[1,3]シフト
光化学的[1,3]シフトは上顔面シフトであるべきである。しかし、ほとんどのシフトは三重項状態を経て進行するため(つまり、Woodward-Hoffmannの規則が適用されないジラジカル機構を持っているため)、不干渉である。
1,5] シフト
1,5]シフトとは、π系の原子数が1個(-H, -R, -Ar)減少することを意味します。水素は200℃以上の温度で環状系と開放鎖系の両方でシフトすることが示されています。これらの反応は、Huckel-topologyの遷移状態により、上面的に進行すると予測されています。
![[1,5] Hydride shift in a cyclic system](https://www.alegsaonline.com/image/300px-1,5hydridecyclicfixed.png)
光照射では水素の反界面シフトが必要となる。このような反応は稀ですが、反界面シフトが有利な例もあります。
![Antarafacial [1,5] Hydride Shift](https://www.alegsaonline.com/image/600px-1,5hantarafacialfixed.png)
水素の[1,5]シフトとは対照的に、開鎖系では[1,5]アルキルシフトが観測されたことはありませんでした。化学者は、環状系における[1,5]アルキルシフトの速度選好性を決定してきた:カルボニルおよびカルボキシル>水素化物>フェニルおよびビニル>アルキル。
アルキル基は[1,5]シフトの進行が非常に悪く、通常は高温を必要とする。しかし、シクロヘキサジエンの場合、アルキルシフトの温度は、最も移行性の高いカルボニル基に比べてそれほど高くありません。ある研究では、シクロヘキサジエンのアルキルシフトは異なるメカニズムで進行するためであることが示された。最初に開環し、[1,7]シフトが起こり、その後、電気環状に改質する。
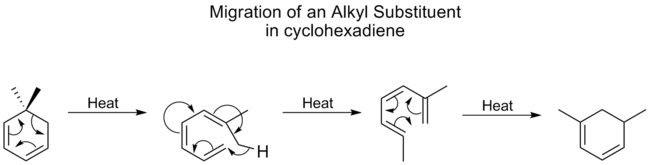
この同様の機構的プロセスは、ビタミンD2へのルミステロールの相互変換において、最終的な電気環状環状閉環反応を伴わずに、以下に見られる。
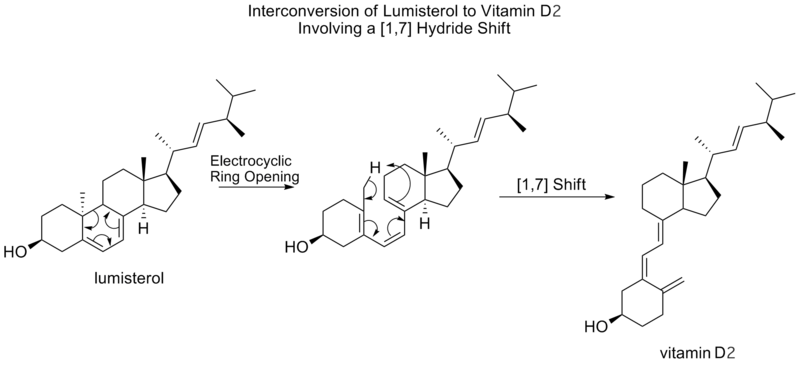
1,7] シフト
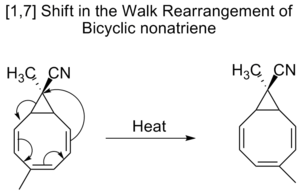
1,7]シグマトロピックシフトは、Woodward-Hoffmannの規則により、メビウスのトポロジー遷移状態により反界面的に進行すると予測されています。反界面的な[1,7]シフトは、ルミステロールのビタミンD2への変換で観測され、プレビタミンD2への電気環開環に続いてメチル水素がシフトします。
二環式ノナトリエンもまた、二環式分子内の三員環の一部として二価の基がシフトする、いわゆるウォーク転位で[1,7]シフトを受ける。
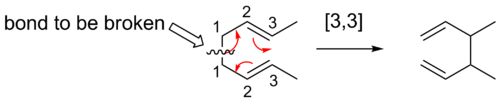
3,3] シフト
3,3]シグマトロピックシフトはよく研究されているシグマトロピック再配列である。Woodward-Hoffmanの規則では、これらの6つの電子反応はHuckelトポロジー遷移状態を用いて上面的に進行すると予測されている。
クレーゼンリアレンジメント
1912年にRainer Ludwig Claisenによって発見されたClaisen転位は、[3,3]-シグマトロピック転位の最初の記録例です。この転位は、有用な炭素-炭素結合形成反応です。Claisen転位の例としては、アリルビニルエーテルの[3,3]転位があり、加熱するとγ,δ-不飽和カルボニルが得られます。カルボニル基の形成により、この反応は他のシグマトロピックな転位とは異なり、本質的に不可逆的な反応となります。

芳香族クレセン転位
オルト-クライセン転位は、アリルフェニルエーテルの中間体への[3,3]シフトを含み、この中間体はすぐにオルト置換フェノールに互変異性化します。
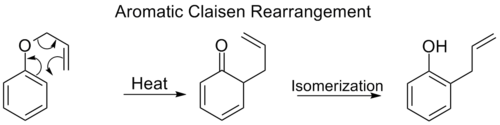
ベンゼン環上の両方のオルト位置がブロックされると、第二のオルト-クライゼン転位が起こります。このパラ-クライゼン転位は、三置換フェノールへの互変異性化で終了します。
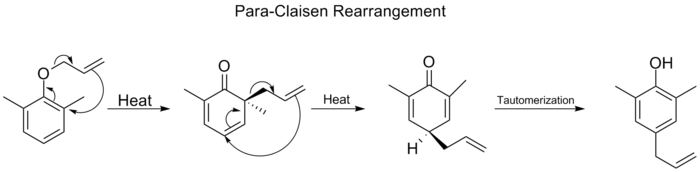
コープリアレンジメント
コープ転位は、1,5-ジエンの[3,3]シグマトロピック転位を伴う有機反応として広く研究されています。これはArthur C. Copeによって開発されました。例えば、3,4-ジメチル-1,5-ヘキサジエンを300℃に加熱すると、2,6-オクタジエンが得られます。

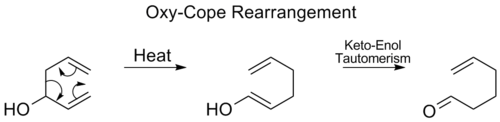
オキシスコープ再配置
オキシコペ転位は、中間体のケト-エノール互変異性体の後、C3に水酸基が付加され、エナールまたはエノンが形成されます。
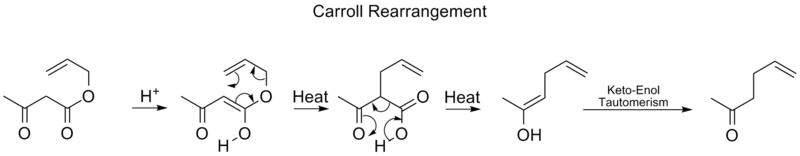
キャロルの再配置
キャロル転位は有機化学における転位反応であり、β-ケトアリルエステルをα-アリル-β-ケトカルボン酸に転化する反応である。この有機反応は、デカルボキシル化に続くことができ、最終生成物はγ,δ-アリルケトンである。キャロル転位は、Claisen転位の適応であり、実質的には脱炭酸アリル化である。
フィッシャーインドール合成
フィッシャーインドール合成とは、酸性条件下で(置換)フェニルヒドラジンとアルデヒドまたはケトンから芳香族複素環インドールを生成する化学反応です。この反応は1883年にヘルマン・エミル・フィッシャーによって発見されました。
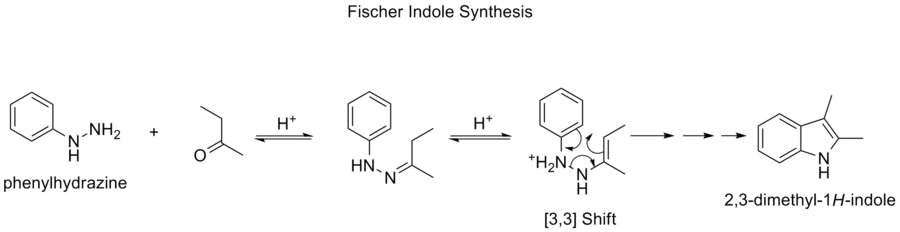
酸触媒の選択は非常に重要です。成功した酸触媒には、以下のものがあります。HCl、H2SO4、ポリリン酸、p-トルエンスルホン酸などのブロンステッド酸。三フッ化ホウ素、塩化亜鉛、塩化鉄、塩化アルミニウムなどのルイス酸も有用な触媒です。
いくつかのレビューが掲載されています。
5,5] シフト
3,3]シフトと同様に、Woodward-Hoffman規則では、[5,5]シグマトロピックシフトは、Huckelトポロジー遷移状態の超ファシアルに進行することが予測されています。これらの反応は、[3,3]シグマトロピックシフトよりも稀であるが、これは主に、[5,5]シフトを受けられる分子が、[3,3]シフトを受けられる分子よりも稀であるという事実の関数である。
![[5,5] shift of phenyl pentadienyl ether](https://www.alegsaonline.com/image/800px-5,5shiftfixeds.png)
ウォークの再配置
二環式分子の三員環の一部であるO、S、NRまたはCR2のような2価の基の移動は、一般にウォーク転位と呼ばれている。これは、Woodward-Hofmannの規則に従って、(1,n)シグマトロピックシフトであることを正式に特徴付けることができる。このような転位の例としては、トロピリデン(1,3,5,5-シクロヘプタトリエン)上の置換基のシフトがあります。加熱すると、π系は電気環状の閉環を経て、ビシクロ[4,1,0]ヘプタジエン(ノルカラジエン)を形成します。その後、[1,5]アルキルシフトと電気環状開環を経て、[4,1,0]ヘプタジエン(ノルカラジエン)となります。
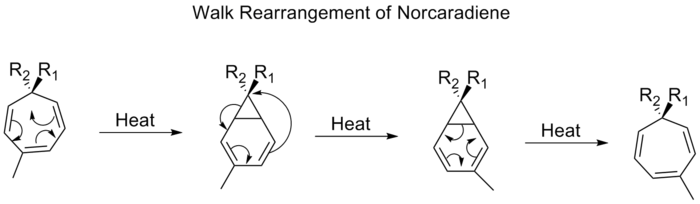
ノルカラジエンのウォーク転位は、[1,5]シフトを経て、立体化学を維持したまま上面的に進行すると予想される。しかし、実験観察では、ノルカラジエンの1,5シフトは反アラファシー的に進行することが示された。理論計算により、[1,5]シフトはジラジカル過程であることがわかったが、ポテンシャルエネルギー面でのジラジカル最小値を伴わないことがわかった。
関連ページ
- 2,3-ジグマトロピック転位
- NIHシフト
- フロンティア分子軌道理論
- ウッドワード・ホフマン規則
質問と回答
Q: 有機化学におけるシグマトロピック反応とは何ですか?
A:シグマトロピック反応とは、無触媒の分子内過程を伴う過環式反応のことで、1つのσ-結合を別のσ-結合に変化させる反応です。
Q: シグマトロピック反応には触媒が必要ですか?
A: 実際のシグマトロピック反応には通常触媒は関与しませんが、ルイス酸によって触媒されるシグマトロピック反応もあります。
Q: "シグマトロピック "とはどういう意味ですか?
A: "シグマトロピック "という言葉は、炭素-炭素結合を意味する "シグマ "と、回転を意味するギリシャ語の "トロポス "からなる合成語です。
Q: シグマトロピック反応とはどのような反応ですか?
A: シグマトロピック反応とは転位反応のことで、分子内の結合が原子間で移動する反応のことです。
Q: 分子内シグマトロピック反応では何が起こりますか?
A: 分子内シグマトロピック反応では、π結合系のある部分から別の部分へ置換基が移動し、同時にπ結合系が再配列します。
Q: 有名なシグマトロピック転位はありますか?
A: 最もよく知られているシグマトロピック転位には、[3,3]Cope転位、Claisen転位、Carroll転位、Fischerインドール合成などがあります。
Q: シグマトロピック反応には遷移金属触媒が関与することが多いのですか?
A: はい、シグマトロピック反応には、類似反応の中間体を形成する遷移金属触媒が存在することがよくあります。
百科事典を検索する